TẠP CHÍ Y HỌC VIỆT NAM TẬP 543 - THÁNG 10 - SỐ CHUYÊN ĐỀ - 2024
27
KẾT QUẢ ĐIỀU TRỊ VIÊM GAN VIRUT B MẠN BẰNG THUỐC
ENTERCAVIR TẠI BỆNH VIỆN TRUNG ƯƠNG THÁI NGUYÊN
Lê Thị Hương Lan1, Đỗ Thị Oanh2
TM TẮT4
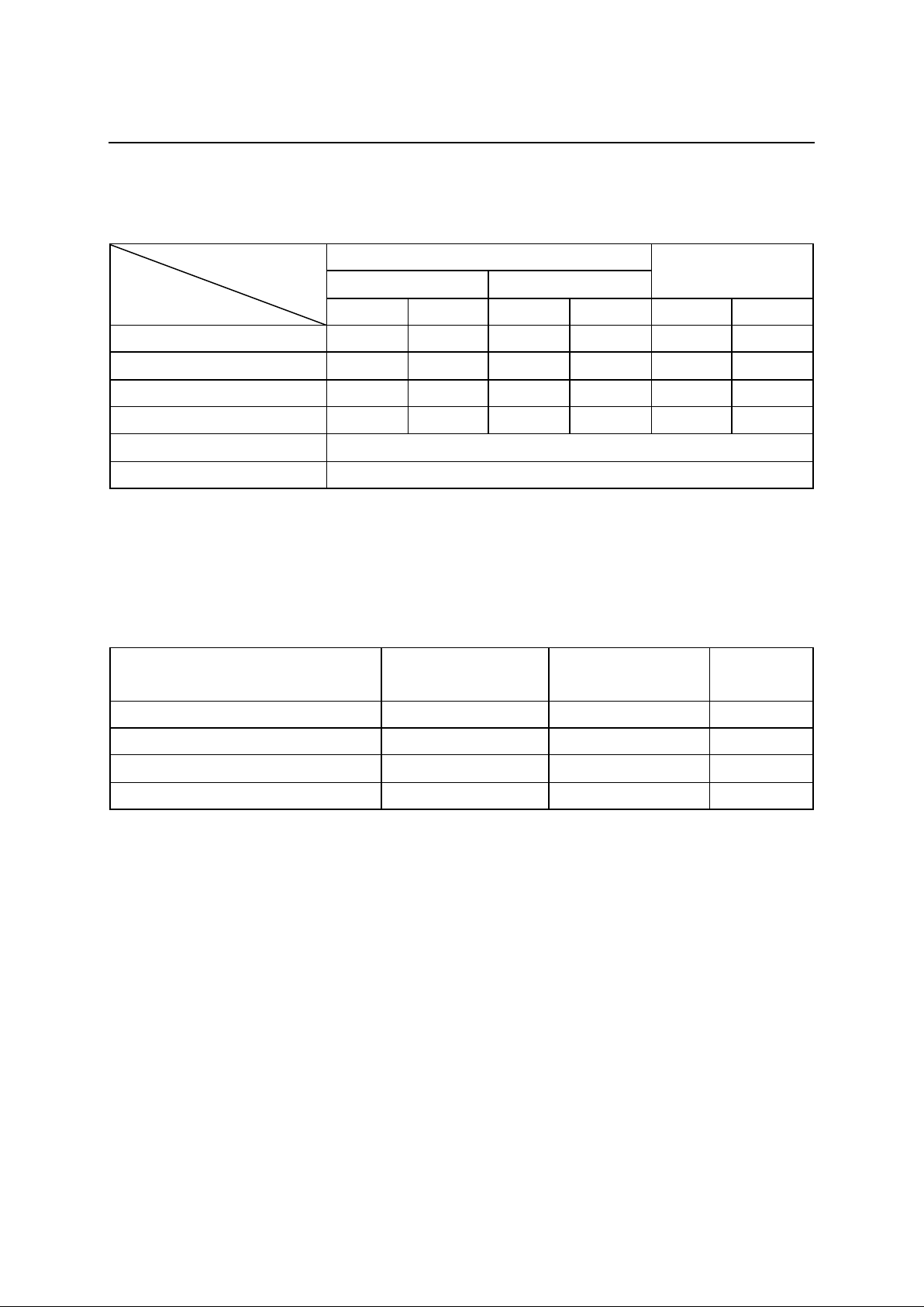
85 bệnh nhân viêm gan virut B mạn tuổi từ
20 đến 71 chưa từng điều trị hoặc ngưng điều trị
với các thuốc kháng virus khác ít nhất 6 tháng
trước khi bắt đầu được lựa chọn vào nghiên cứu.
Bệnh nhân được làm xt nghiệm đo hoạt độ
enzym gan, đo độ xơ hóa gan và đo tải lượng
virus trước khi điều trị bằng entercavir 0,5 mg /
ngày, thời gian điều trị 12 tháng. Đánh giá kết
quả sinh hóa máu, mô học và tải lượng virus ở
tháng thứ 3, 6, 12. Tác dụng phụ được theo dõi
ghi nhận trong suốt quá trình điều trị. Kết quả
sau 12 tháng điều trị 100% bệnh nhân có hoạt độ
ALT trở về bình thường, mức độ xơ hóa gan trở
về bình thường chiếm tỷ lệ rất cao 95,3%. Tải
lượng HBVDNA trở về dưới ngường phát hiện là
85,8%. Tác dụng phụ không đáng kể, không có
bệnh nhân nào phải ngưng thuốc điều trị. Kết
luận: Entercavir có hiệu quả cao trong điều trị
bệnh nhân viêm gan B mạn tính, an toàn, hầu
như không có tác dụng phụ.
Từ khóa: Viêm gan virus B, điều trị gan B,
xơ hóa gan, tải lượng virus, entercavir
1Khoa Sinh hóa, Bệnh viện trung ương Thi
2Khoa Khám chữa bệnh yêu cầu, Bệnh viện trung
ương Thi
Chịu trách nhiệm chính : Lê Thị Hương Lan,
SĐT: 0982090308
Email: lanhuong.bvtutn@gmail.com
Ngày nhận bài: 01/6/2024
Ngày phản biện khoa học: 10/6/2024
Ngày duyệt bài: 25/7/2024
SUMMARY
RESULTS OF CHRONIC HEPATITIS B
VIRUS TREATMENT WITH
ENTERCAVIR AT THAI NGUYEN
CENTRAL HOSPITAL
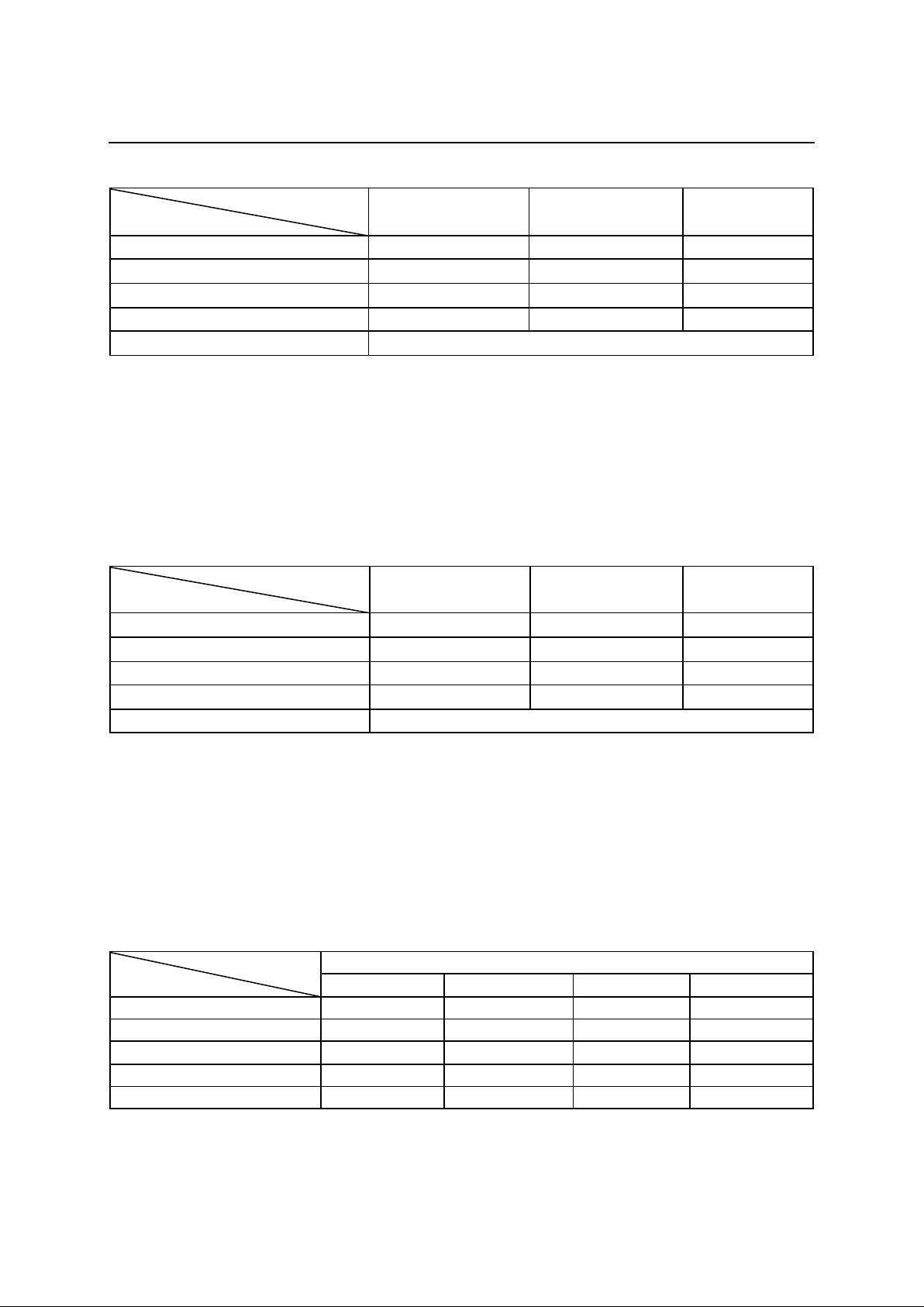
85 patients with chronic hepatitis B virus
aged 20 to 71 years old who had never been
treated or stopped treatment with other antiviral
drugs at least 6 months before the start of the
study were selected. Patients were tested to
measure liver enzyme activity, measure liver
fibrosis, and measure viral load before treatment
with entercavir 0.5 mg/day for a 12-month
treatment period. Evaluate the results of blood
chemistry, histology, and viral load at months 3,
6, and 12. Side effects are monitored and
recorded throughout the treatment process.
Results: After 12 months of treatment, 100% of
patients had ALT activity returned to normal, and
the level of liver fibrosis returned to normal,
accounting for a very high rate of 95.3%.
HBVDNA load returned below the detection
limit of 85.8%. Side effects were insignificant;
no patient had to stop treatment. Conclusion:
Entercavir is highly effective in treating patients
with chronic hepatitis B, is safe, and has almost
no side effects.
Keywords: Hepatitis B virus, hepatitis B
treatment, liver fibrosis, viral load, entercavir
I. ĐẶT VẤN ĐỀ
Nhiễm virus B gây viêm gan (Hepatitis B
Virus = HBV) vẫn được coi là một vấn đề
sức khỏe toàn cầu. Hiện nay, trên thế giới
ước tính có trên 2 tỷ người đã từng hay đang