Ngày nhận bài: 16-12-2024 / Ngày chấp nhận đăng bài: 22-01-2024 / Ngày đăng bài: 28-01-2025
*Tác giả liên hệ: Nguyễn Quí Hiển. Khoa Dược, Đại học Y Dược Thành phố Hồ Chí Minh, Thành phố Hồ Chí Minh, Việt Nam.
E-mail: nguyenquihien@ump.edu.vn
© 2025 Bản quyền thuộc về Tạp chí Y học Thành phố Hồ Chí Minh.
58 https://www.duoc.tapchiyhoctphcm.vn
ISSN : 1859-1779
Nghiên cứu Dược học
Tạp chí Y học Thành phố Hồ Chí Minh - Dược học;28(1):58-65
https://doi.org/10.32895/hcjm.p.2025.01.07
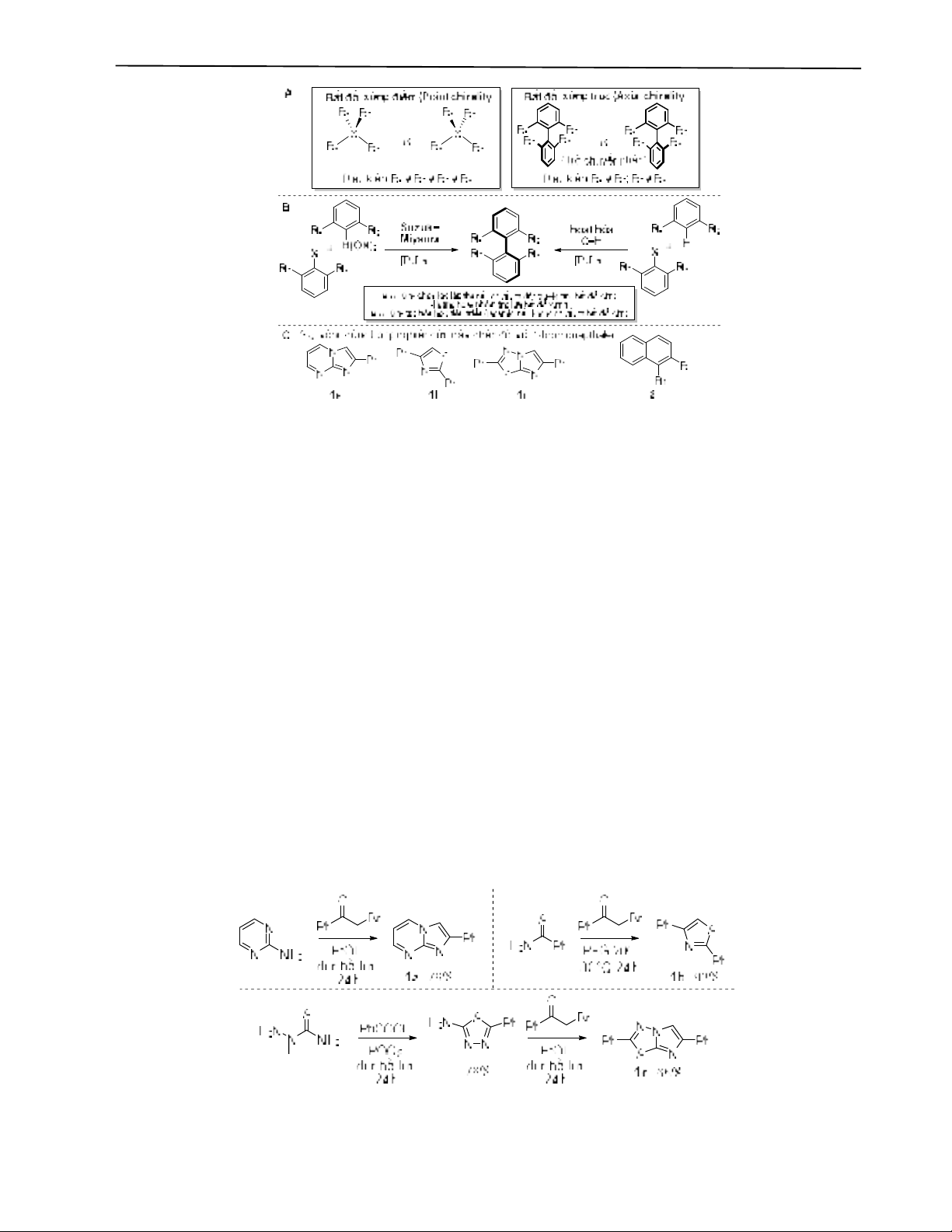
Tổng hợp biaryl bất đối xứng trục chứa dị vòng
tiềm năng sinh học
Huỳnh Hoàng Thúc1, Đặng Thiên Phước1, Nguyễn Quí Hiển1,*
1Khoa Dược, Đại học Y Dược Thành phố Hồ Chí Minh, Thành phố Hồ Chí Minh, Việt Nam
Tóm tắt
Mục tiêu: Trở chuyển phân (atropisomer) là một xu hướng đang lên trong khám phá thuốc mới. Các nghiên cứu gần đây
đã phát triển thành công phản ứng tạo nối biaryl chọn lọc lập thể trở chuyển phân, ứng dụng cho một số dị vòng thơm
cụ thể. Nhằm góp phần mở rộng phạm vi cơ chất dị vòng cho phản ứng này, chúng tôi nghiên cứu khảo sát thêm một
số điều kiện aryl hóa, tạo sản phẩm trở chuyển phân dưới dạng hỗn hợp tiêu triền (racemic), và ứng dụng tổng hợp các
sản phẩm biaryl trở chuyển phân khác mang các dị vòng có tiềm năng hoạt tính sinh học.
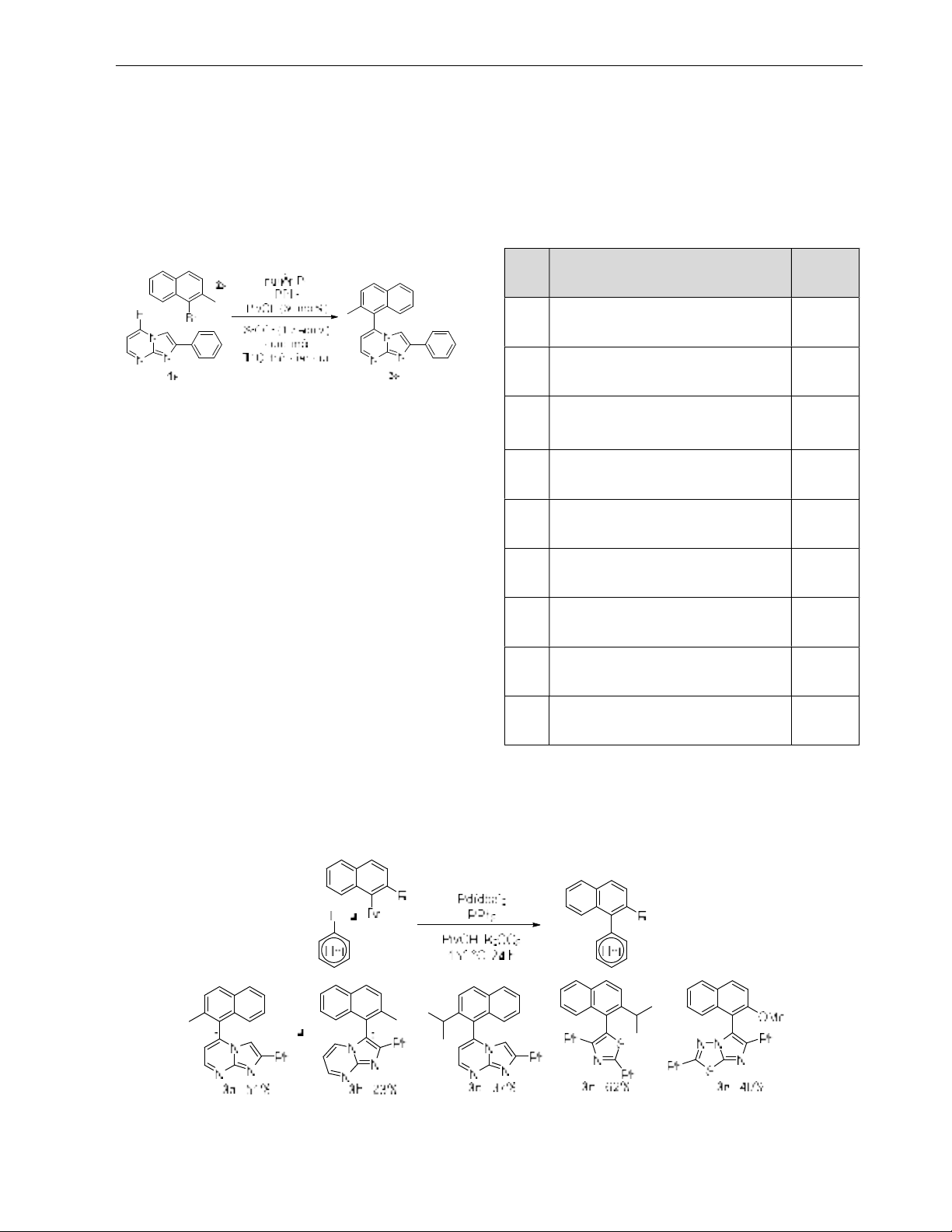
Đối tượng và phương pháp nghiên cứu: Chúng tôi khảo sát các điều kiện phản ứng từ quy trình của Fagnou, như nguồn
và tỉ lệ Pd, dung môi, nhiệt độ, thời gian đun. Điều kiện phản ứng này sau đó được áp dụng cho tổng hợp các hợp chất
biaryl dị vòng trở chuyển phân.
Kết quả: Bằng cách thay đổi dung môi, nhiệt độ, nguồn Pd, phản ứng cho hiệu suất tốt hơn quy trình của Fagnou đối với
cơ chất cồng kềnh. Năm sản phẩm biaryl trở chuyển phân mới đã được tổng hợp, cấu trúc của chúng được chứng minh
bằng các dữ liệu phổ.
Kết luận: Quy trình mới được ứng dụng để tổng hợp các hợp chất trở chuyển phân mới, là tiền đề cho các nghiên cứu
ứng dụng trở chuyển phân trong khám phá thuốc mới, cũng như làm tiền chất tổng hợp một số hợp chất thiên nhiên.
Từ khóa: Trở chuyển phân; dị vòng thơm; biaryl; hoạt hóa liên kết C-H
Abstract
SYNTHESIS OF AXIALLY ASYMMETRIC BIARYL COMPOUNDS
CONTAINING HETEROARENES WITH POTENTIAL BIOLOGICAL
ACTIVITIES
Huynh Hoang Thuc, Dang Thien Phuoc, Nguyen Qui Hien
Objectives: Atropisomers have been an emerging trend in drug discovery in recent years. Researchers have been
successful in developing atropo-enantioselective biaryl formation reactions, applied to a few specific heteroarenes. In