
Bài 7
XÁC TÁC Đ NG TH – PH N NG PHÂN H Y HỒ Ể Ả Ứ Ủ 2O2
------------------------------
I. M C ĐÍCHỤ
oXác đ nh h ng s v n t c ph n ng k, chu kỳ bán h y ị ằ ố ậ ố ả ứ ủ τ, năng l ng ho t hóa Eượ ạ a c aủ
ph n ng phân h y Hả ư ủ 2O2 có ion Cu2+ làm xúc tác.
oPh n ng phân h y Hả ứ ủ 2O2 là ph n ng b c 1 t ng quát. ả ứ ậ ổ
II. C S LÝ THUY TƠ Ở Ế
H2O2 t phân h y và phân h y nhanh h n khi có s hi n c a Pt hay mu i c a các kimự ủ ủ ơ ự ệ ủ ố ủ
lo i chuy n ti p nh Cuạ ể ế ư 2+, Fe3+, Cr3+, Ni2+,…
Ph n ng phân h y c a Hả ứ ủ ủ 2O2 theo hai giai đo n:ạ
•Giai đo n 1: HOOH Oạ2 + 2H (ch m)ậ
•Giai đo n 2: HOOH + 2H 2Hạ2O (nhanh)
H2O2 H2O + O2
V n t c ph n ng đ c xác đ nh căn c vào giai đo n ch m nên ph n ng phân h yậ ố ả ứ ượ ị ứ ạ ậ ả ứ ủ
H2O2 có b c 1 theo Hậ2O2 cũng b c 1 t ng quát.ậ ổ
•Ph ng trình đ ng h c c a ph n ng b c 1 có d ng sau: ươ ộ ọ ủ ả ứ ậ ạ
•T ph ng trình (ừ ươ *), ta v đ th bi u di n s ph thu c ẽ ồ ị ể ễ ụ ụ ộ theo th i gian t và tìmờ
đ c h s v n t c k. ượ ệ ố ậ ố
•Tuy nhiên, ta cũng có th xác đ nh k thong qua đ th bi u di n s ph thu c c aể ị ồ ị ể ễ ự ụ ộ ủ
theo t vì th i gian càng lâu thì n ng đ c a Hờ ồ ộ ủ 2O2 càng gi m – phân h y càng nhi u kéo theoả ủ ề
th tích KMnOể4 s d ng đ chu n đ Hử ụ ể ẩ ộ 2O2 còn l i càng gi m nên n ng đ Hạ ả ồ ộ 2O2 theo th iờ
gian t cũng t l v i th tích KMnOỉ ệ ớ ể 4 đã ph n ng theo th i gian t.ả ứ ờ
•T ph ng trình đ ng h c (ừ ươ ộ ọ *), ta tìm đ c chu kỳ bán h y ượ ủ τ:
•Ta th c hi n ph n ng phân h y c a Hự ệ ả ứ ủ ủ 2O2 hai nhi t đ 30 ở ệ ộ oC và 40 oC nên tìm
đ c giá tr c a h ng s v n t c kượ ị ủ ằ ố ậ ố 1 và k2 cũng nh chu kỳ bán h y ư ủ τ1 và τ2 và áp d ng côngụ
th c Arrhenius (liên h gi a h ng s v n t c k theo nhi t đ T đ xác đ nh năng l ng ho tứ ệ ữ ằ ố ậ ố ệ ộ ể ị ượ ạ
hóa Ea):
III. TH C HÀNHỰ(th c hi n đ ng th i nhi t đ 30 ự ệ ồ ờ ở ệ ộ oC và 40 oC)
1. Th c hi n ph n ng 30 ự ệ ả ứ ở o
C :
B t máy đi u nhi t và ch n 30 ậ ề ệ ọ oC; máy đi u nhi t 2 ch n 40 ề ệ ọ oC.
Dùng pipet 1 mL hút 1 mL dung d ch Hị2O2 30% cho vào erlen 100 mL ch a s n 19ứ ẵ
mL n c c t (dùng pipet 25 mL). Dùng ng đong 10 mL l y 10 mL dung d ch CuSOướ ấ ố ấ ị 4 10 % cho
vào erlen 100 mL khác. R i đ t 2 erlen trên vào b đi u nhi t 30 ồ ặ ể ề ệ oC (th i đi m tờ ể o).
Đ yên 2 erlen cho dung d ch trong 2 erlen có nhi t đ là 30 ể ị ệ ộ oC.
Đ n th i đi m (tế ờ ể o + 10) phút, tr n l n 2 erlen v i nhau, l c đ u h n h p và độ ẫ ớ ắ ề ỗ ợ ể
erlen (ch a h n h p 2 dung d ch) vào b đi u nhi t 30 ứ ỗ ợ ị ể ề ệ oC.
Do chúng ta kh o sát s phân h y c a Hả ự ủ ủ 2O2 có s hi n di n Cuự ệ ệ 2+ làm xúc tác nên
th i đi m 0 là không quan tr ng nh ng c n chính xác các th i đi m sau đó. ờ ể ọ ư ầ ờ ể
Đ n th i đi m (tế ờ ể o + 15) phút, dùng pipet 2 mL hút 2 mL dung d ch trong erlen trongị
b đi u nhi t 30 ể ề ệ oC cho vào erlen 250 mL ch a s n 3 mL dung d ch Hứ ẵ ị 2SO4 10% (dùng ngố
đong). Dung d ch có ịmàu xanh nh tạ c a CuSOủ4.

Ti n hành chu n đế ẩ ộ:
•Tráng buret 25 mL b ng dung d ch KMnOằ ị 4 0.1 N và cho dung d ch KMnOị4 0.1 –
ch nh v v ch 0 mL.ỉ ề ạ
•M khóa cho ch y vào erlen đ n khi dung d ch trong erlen chuy n t ở ả ế ị ể ừ màu xanh
nh tạ sang màu tím nh tạ thì k t thúc quá trình chu n đ . Ghi nh n giá tr th tích dung d chế ẩ ộ ậ ị ể ị
KMnO4 0.1 N đã dùng là V1 (mL).
•Ph ng trình chu n đ : ươ ẩ ộ
5H2O2 + 2KMnO4 + 3H2SO4 5O2 + 2MnSO4 + K2SO4 + 8H2O
Đ n th i đi m (tế ờ ể o + 15 + 5) phút, dùng pipet 2 mL hút 2 mL dung d ch trong erlenị
(đ t trong b đi u nhi t) cho vào erlen ch a s n 3 mL dung d ch Hặ ể ề ệ ứ ẵ ị 2SO4 10% (dùng ng đong).ố
Ti p t c chu n đ và ghi nh n giá tr th tích c a dung d ch KMnOế ụ ẩ ộ ậ ị ể ủ ị 40.1 N đã dùng là V2 (mL).
Làm t ng t đ n th i đi m ươ ự ế ờ ể (to + 15 + 45) phút thì ng ng. Khi đó, ta thu đ cừ ượ
b ng s li u sau:ả ố ệ
Th i đi m (phút)ờ ể (to + 15) (to + 20) (to + 25) (to + 30) (to + 35) (to + 45)
Th tích dd KMnOể4 0.1 N (mL) 11.3 9.3 8 6.9 5.9 2.8
T b ng s li u, ta v đ c đ th bi u di n theo th i gian t:ừ ả ố ệ ẽ ượ ồ ị ể ễ ờ
T đ th , ta ngo i suy tìm đ c: ừ ồ ị ạ ượ
Suy ra: Chu ký bán h y ủ:
2. Th c hi n ph n ng 40 ự ệ ả ứ ở o
C :
Dùng pipet 1 mL hút 1 mL dung d ch Hị2O2 30% cho vào erlen 100 mL ch a s n 19ứ ẵ
mL n c c t (dùng pipet 25 mL). Dùng ng đong 10 mL l y 10 mL dung d ch CuSOướ ấ ố ấ ị 4 10 % cho
vào erlen 100 mL khác. R i đ t 2 erlen trên vào b đi u nhi t 40 ồ ặ ể ề ệ oC (th i đi m tờ ể o).
Đ yên 2 erlen cho dung d ch trong 2 erlen có nhi t đ là 40 ể ị ệ ộ oC.
Đ n th i đi m (tế ờ ể o + 10) phút, tr n l n 2 erlen v i nhau, l c đ u h n h p và độ ẫ ớ ắ ề ỗ ợ ể
erlen (ch a h n h p 2 dung d ch) vào b đi u nhi t 40 ứ ỗ ợ ị ể ề ệ oC.
Do chúng ta kh o sát s phân h y c a Hả ự ủ ủ 2O2 có s hi n di n Cuự ệ ệ 2+ làm xúc tác nên
th i đi m 0 là không quan tr ng nh ng c n chính xác các th i đi m sau đó. ờ ể ọ ư ầ ờ ể
Đ n th i đi m (tế ờ ể o + 15) phút, dùng pipet 2 mL hút 2 mL dung d ch trong erlen trongị
b đi u nhi t 40 ể ề ệ oC cho vào erlen 250 mL ch a s n 3 mL dung d ch Hứ ẵ ị 2SO4 10% (dùng ngố
đong). Dung d ch có ịmàu xanh nh tạ c a CuSOủ4.
Ti n hành chu n đế ẩ ộ:
•Tráng buret 25 mL b ng dung d ch KMnOằ ị 4 0.1 N và cho dung d ch KMnOị4 0.1 –
ch nh v v ch 0 mL.ỉ ề ạ
•M khóa cho ch y vào erlen đ n khi dung d ch trong erlen chuy n t ở ả ế ị ể ừ màu xanh
nh tạ sang màu tím nh tạ thì k t thúc quá trình chu n đ . Ghi nh n giá tr th tích dung d chế ẩ ộ ậ ị ể ị
KMnO4 0.1 N đã dùng là V1 (mL).
•Ph ng trình chu n đ : ươ ẩ ộ
5H2O2 + 2KMnO4 + 3H2SO4 5O2 + 2MnSO4 + K2SO4 + 8H2O
Đ n th i đi m (tế ờ ể o + 15 + 5) phút, dùng pipet 2 mL hút 2 mL dung d ch trong erlenị
(đ t trong b đi u nhi t) cho vào erlen ch a s n 3 mL dung d ch Hặ ể ề ệ ứ ẵ ị 2SO4 10% (dùng ng đong).ố
Ti p t c chu n đ và ghi nh n giá tr th tích c a dung d ch KMnOế ụ ẩ ộ ậ ị ể ủ ị 40.1 N đã dùng là V2 (mL).
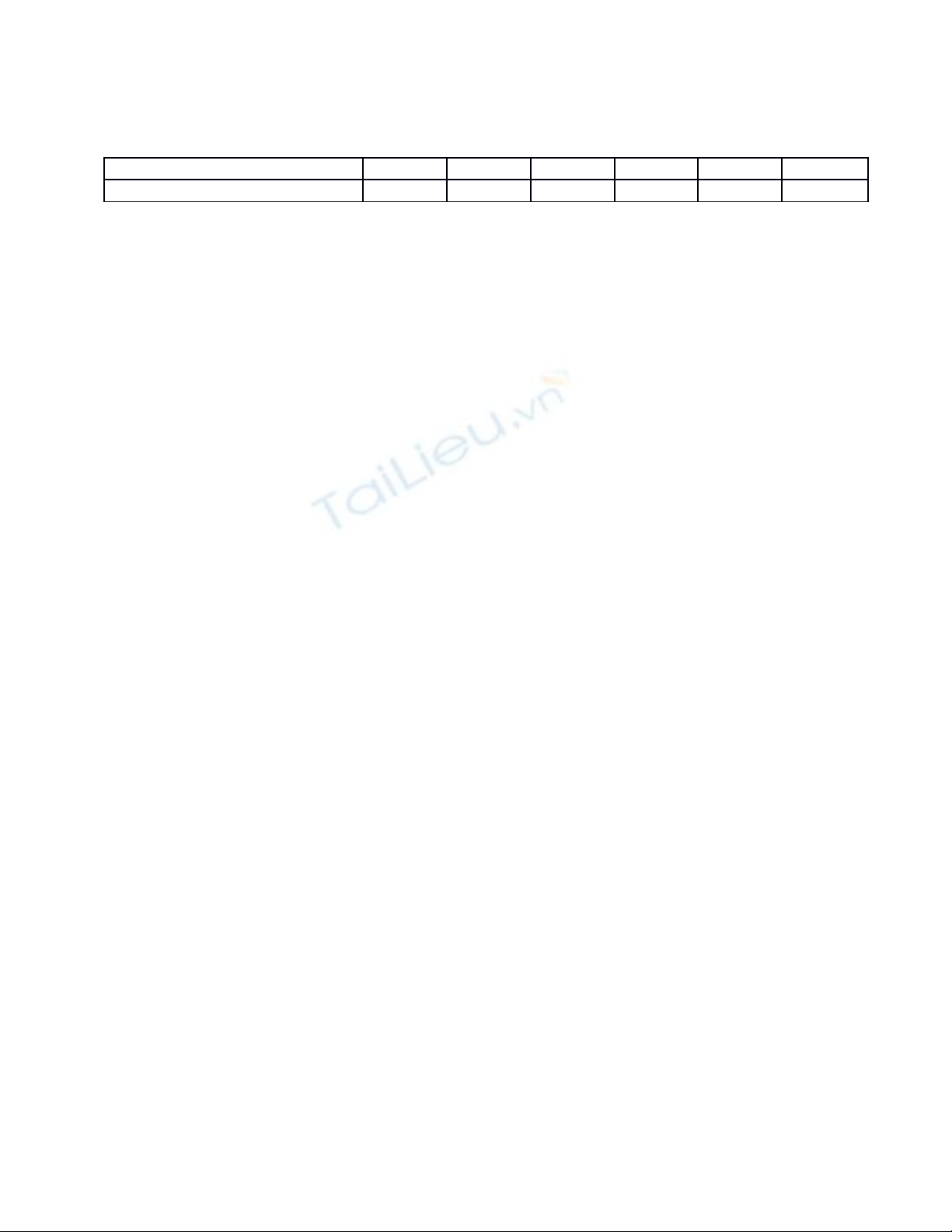
Làm t ng t đ n th i đi m ươ ự ế ờ ể (to + 15 + 45) phút thì ng ng. Khi đó, ta thu đ cừ ượ
b ng s li u sau:ả ố ệ
Th i đi m (phút)ờ ể (to + 0) (to + 5) (to + 10) (to + 15) (to + 20) (to + 30)
Th tích dd KMnOể4 0.1 N (mL) 9.1 8.7 5 4 3.4 2.5
T b ng s li u, ta v đ c đ th bi u di n theo th i gian t:ừ ả ố ệ ẽ ượ ồ ị ể ễ ờ
T đ th , ta ngo i suy tìm đ c: ừ ồ ị ạ ượ
Suy ra: Chu kỳ bán h y ủ:
= 1.823 (phút)
Áp d ng công th c Arrhenius đ xác đ nh năng l ng ho t hóa Eụ ứ ể ị ượ ạ a:





![Bài tập so sánh hơn và so sánh nhất của tính từ [kèm đáp án/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250808/nhatlinhluong27@gmail.com/135x160/77671754900604.jpg)
![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)




![Tài liệu Lý thuyết và Bài tập Tiếng Anh lớp 6 [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250802/hoihoangdang@gmail.com/135x160/18041754292798.jpg)




