
CHƯƠNG III. DUNG DỊCH - ĐIỆN LI – pH
I. DUNG DỊCH
1. Định nghĩa.
Dd là hệ đồng thể gồm hai hay nhiều chất mà tỷ lệ thành phần của chúng có thể thay
đổi trong một giới hạn khá rộng.
Dd gồm: các chất tan và dung môi.
Dung môi là môi trường để phân bổ các phân tử hoặc ion chất tan. Thường gặp dung
môi lỏng và quan trọng nhất là H2O.
2. Quá trình hoà tan.
Khi hoà tan một chất thường xảy ra 2 quá trình.
Phá huỷ cấu trúc của các chất tan.
Tương tác của dung môi với các tiểu phân chất tan.
Ngoài ra còn xảy ra hiện tượng ion hoá hoặc liên hợp phân tử chất tan (liên kết hiđro).
Ngược với quá trình hoà tan là quá trình kết tinh. Trong dd, khi tốc độ hoà tan bằng
tốc độ kết tinh, ta có dd bão hoà. Lúc đó chất tan không tan thêm được nữa.
3. Độ tan của các chất.
Độ tan được xác định bằng lượng chất tan bão hoà trong một lượng dung môi xác
định. Nếu trong 100 g H2O hoà tan được:
>10 g chất tan: chất dễ tan hay tan nhiều.
<1 g chất tan: chất tan ít.
< 0,01 g chất tan: chất thực tế không tan.
4. Tinh thể ngậm nước.
Quá trình liên kết các phân tử (hoặc ion) chất tan với các phân tử dung môi gọi là quá
trình sonvat hoá. Nếu dung môi là H2O thì đó là quá trình hiđrat hoá.
Hợp chất tạo thành gọi là sonvat (hay hiđrat).
Ví dụ: CuSO4.5H2O ; Na2SO4.1OH2O.
Các sonvat (hiđrat) khá bền vững. Khi làm bay hơi dd thu được chúng ở dạng tinh thể,
gọi là những tinh thể ngậm H2O. Nước trong tinh thể gọi là nước kết tinh.
Một số tinh thể ngậm nước thường gặp:
FeSO4.7H2O, Na2SO4.1OH2O, CaSO4.2H2O.
5. Nồng độ dd
Nồng độ dd là đại lượng biểu thị lượng chất tan có trong một lượng nhất định dd hoặc
dung môi.
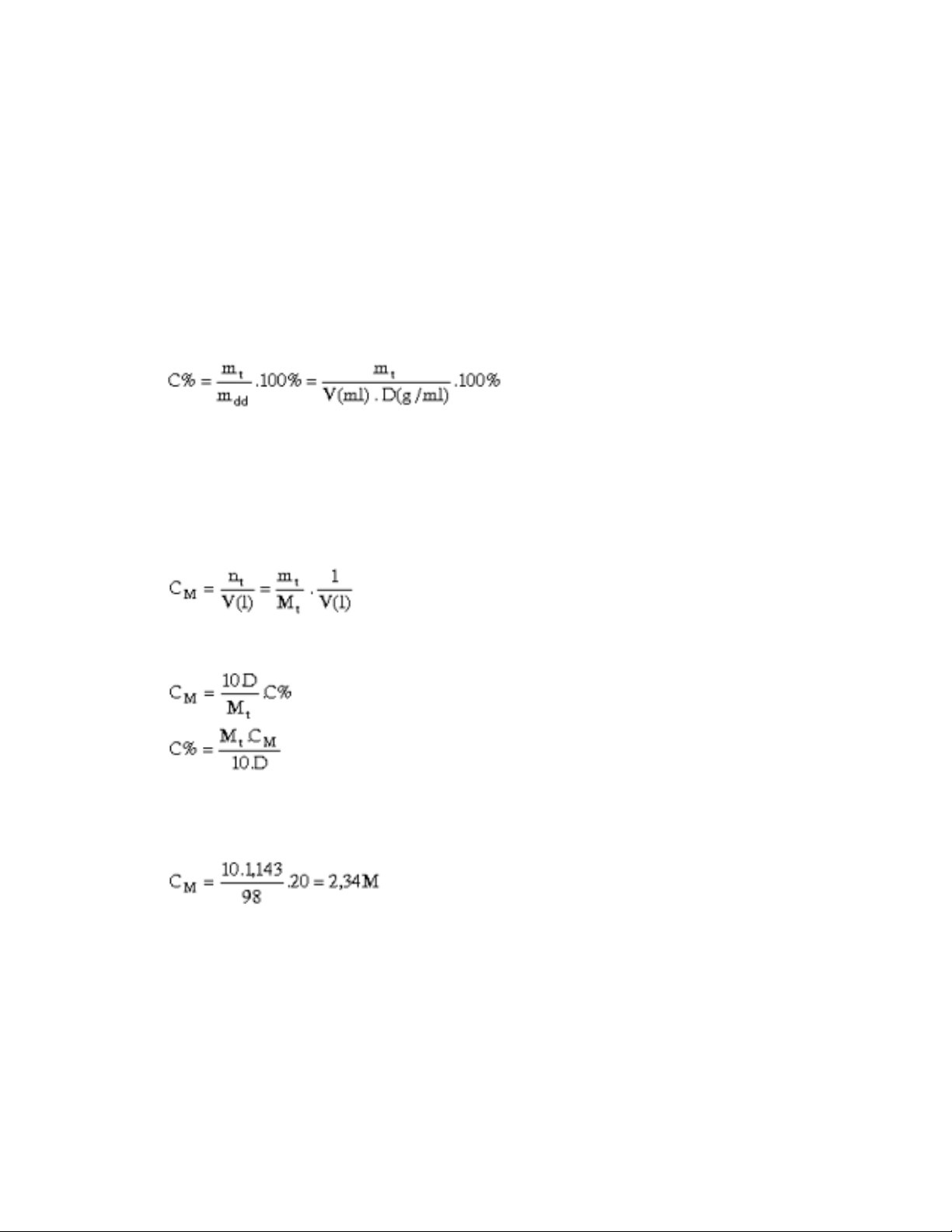
a) Nồng độ phần trăm (C%). Nồng độ phần trăm được biểu thị bằng số gam chất tan
có trong 100 g dd.
Trong đó : mt, mdd là khối lượng của chất tan và của dd.
V là thể tích dd (ml), D là khối lượng riêng của dd (g.ml)
b) Nồng độ mol (CM). Nồng độ mol được biểu thị bằng số mol chất tan trong 1 lít dd.
Ký hiệu là M.
c) Quan hệ giữa C% và CM.
Ví dụ : Tính nồng độ mol của dd axit H2SO4 20%, có D = 1,143 g.ml
Giải : Theo công thức trên ta có :
II. SỰ ĐIỆN LI
1. Định nghĩa.
Sự điện li là quá trình phân li chất tan thành các ion dưới tác dụng của các phân tử
dung môi (thường là nước) hoặc khi nóng chảy.
Ion dương gọi là cation, ion âm gọi là anion.

Chất điện ly là những chất tan trong nước tạo thành dd dẫn điện nhờ phân ly thành
các ion.
Ví dụ: Các chất muối axit, bazơ.
Chất không điện li là chất khi tan trong nước tạo thành dd không dẫn điện.
Ví dụ: Dd đường, dd rượu,…
Nếu chất tan cấu tạo từ các tinh thể ion (như NaCl, KOH,…) thì quá trình điện ly là
quá trình điện li là quá trình tách các ion khỏi mạng lưới tinh thể rồi sau đó ion kết hợp
với các phân tử nước tạo thành ion hiđrat.
Nếu chất tan gồm các phân tử phân cực (như HCl, HBr, HNO3,…) thì đầu tiên xảy
ra sự ion hoá phân tử và sau đó là sự hiđrat hoá các ion.
Phân tử dung môi phân cực càng mạnh thì khả năng gây ra hiện tượng điện li đối với
chất tan càng mạnh.
Trong một số trường hợp quá trình điện li liên quan với khả năng tạo liên kết hiđro của
phân tử dung môi (như sự điện li của axit).
2. Sự điện li của axit, bazơ, muối trong dd nước.
a) Sự điện li của axit
Axit điện li ra cation H+ (đúng hơn là H3O+) và anion gốc axit.
Để đơn giản, người ta chỉ viết
Nếu axit nhiều lần axit thì sự điện li xảy ra theo nhiều nấc, nấc sau yếu hơn nấc trước.
b) Sự điện li của bazơ.
Bazơ điện li ra anion OH
và cation kim loại hoặc amoni.
This imag e cann ot cu rren tly be d isplayed .
This imag e cann ot cu rren tly be d isplayed .
This imag e cann ot cu rren tly be d isplayed .

Nếu bazơ nhiều lần bazơ thì sự điện li xảy ra theo nhiều nấc, nấc sau yếu hơn nấc
trước.
c) Sự điện li của muối.
Muối điện li ra cation kim loại hay amoni và anion gốc axit, các muối trung hoà
thường chỉ điện li 1 nấc.
Muối axit, muối bazơ điện li nhiều nấc :
Muối bazơ :
d) Sự điện li của hiđroxit lưỡng tính.
Hiđroxit lưỡng tính có thể điện li theo 2 chiều ra cả ion H+ và OH
.
3. Chất điện li mạnh và chất điện li yếu.
a) Chất điện li mạnh.
Chất điện li mạnh là những chất trong dd nước điện li hoàn toàn thành ion. Quá trình
điện li là quá trình một chiều, trong phương trình điện li dùng dấu =. Ví dụ:
This imag e cann ot cu rren tly be d isplayed .
This imag e cann ot cu rren tly be d isplayed .

Những chất điện li mạnh là những chất mà tinh thể ion hoặc phân tử có liên kết phân
cực mạnh.
Đó là:
Hầu hết các muối tan.
Các axit mạnh: HCl, HNO3, H2SO4,…
Các bazơ mạnh: NaOH, KOH, Ca(OH)2,…
b) Chất điện li yếu
Chất điện li yếu là những chất trong dd nước chỉ có một phần nhỏ số phân tử điện li
thành ion còn phần lớn tồn tại dưới dạng phân tử, trong phương trình điện li dùng dấu
thuận nghịch
Ví dụ:
Những chất điện li yếu thường gặp là:
Các axit yếu: CH3COOH, H2CO3, H2S,…
Các bazơ yếu: NH4OH,…
Mỗi chất điện li yếu được đặc trưng bằng hằng số điện li (Kđl) - đó là hằng số cân
bằng của quá trình điện li. Ví dụ:
Trong đó: CH3COO, H+ và CH3COOH là nồng độ các ion và phân tử trong dd
lúc cân bằng. Kđl là hằng số, không phụ thuộc nồng độ. Chất điện li càng yếu thì Kđl càng
nhỏ.
Với chất điện li nhiều nấc, mỗi nấc có Kđl riêng. H2CO3 có 2 hằng số điện li:





![Bài tập so sánh hơn và so sánh nhất của tính từ [kèm đáp án/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250808/nhatlinhluong27@gmail.com/135x160/77671754900604.jpg)
![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)




![Tài liệu Lý thuyết và Bài tập Tiếng Anh lớp 6 [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250802/hoihoangdang@gmail.com/135x160/18041754292798.jpg)




