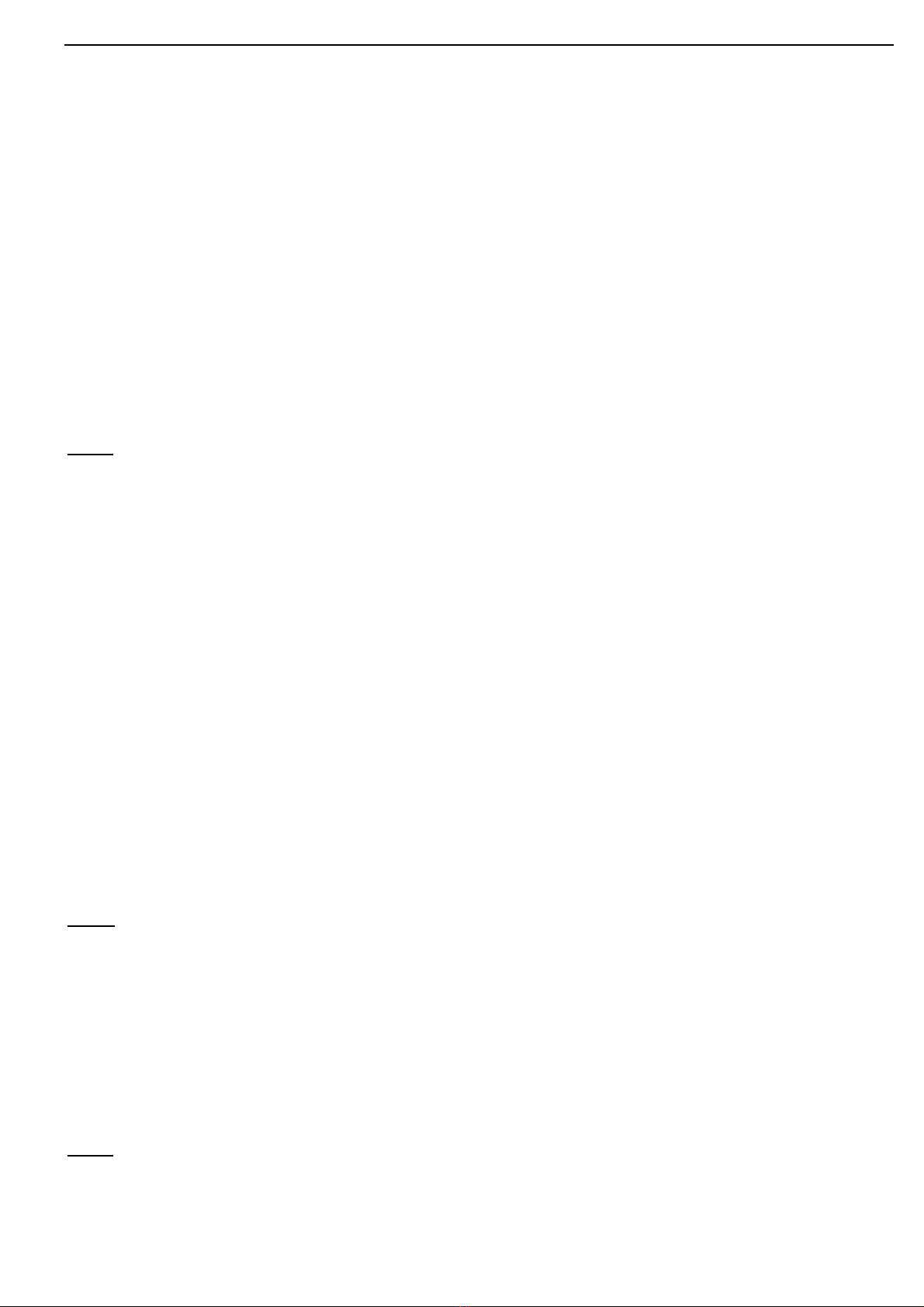
Axit
+ Ch t ch th màuấ ỉ ị Quì tím hóa đ ỏ
+ Kim lo iạ
+ Bazơ
Mu i + Hố2
Mu i + n c (9)ố ướ
+ Oxit bazơMu i + n c (10)ố ướ
+ Mu iốMu i m i + ax m iố ớ ớ 11
Đ C NG ÔN T P H C KÌ I - HOÁ H C 9 Ề ƯƠ Ậ Ọ Ọ ` Năm h c: 2018-ọ
2019
PH N A – KI N TH C C B N.Ầ Ế Ứ Ơ Ả
I – CÁC LO I H P CH T VÔ C :Ạ Ợ Ấ Ơ
1. OXIT Vd: CaO, SO2, CO, Na2O, Fe3O4, P2O5, …
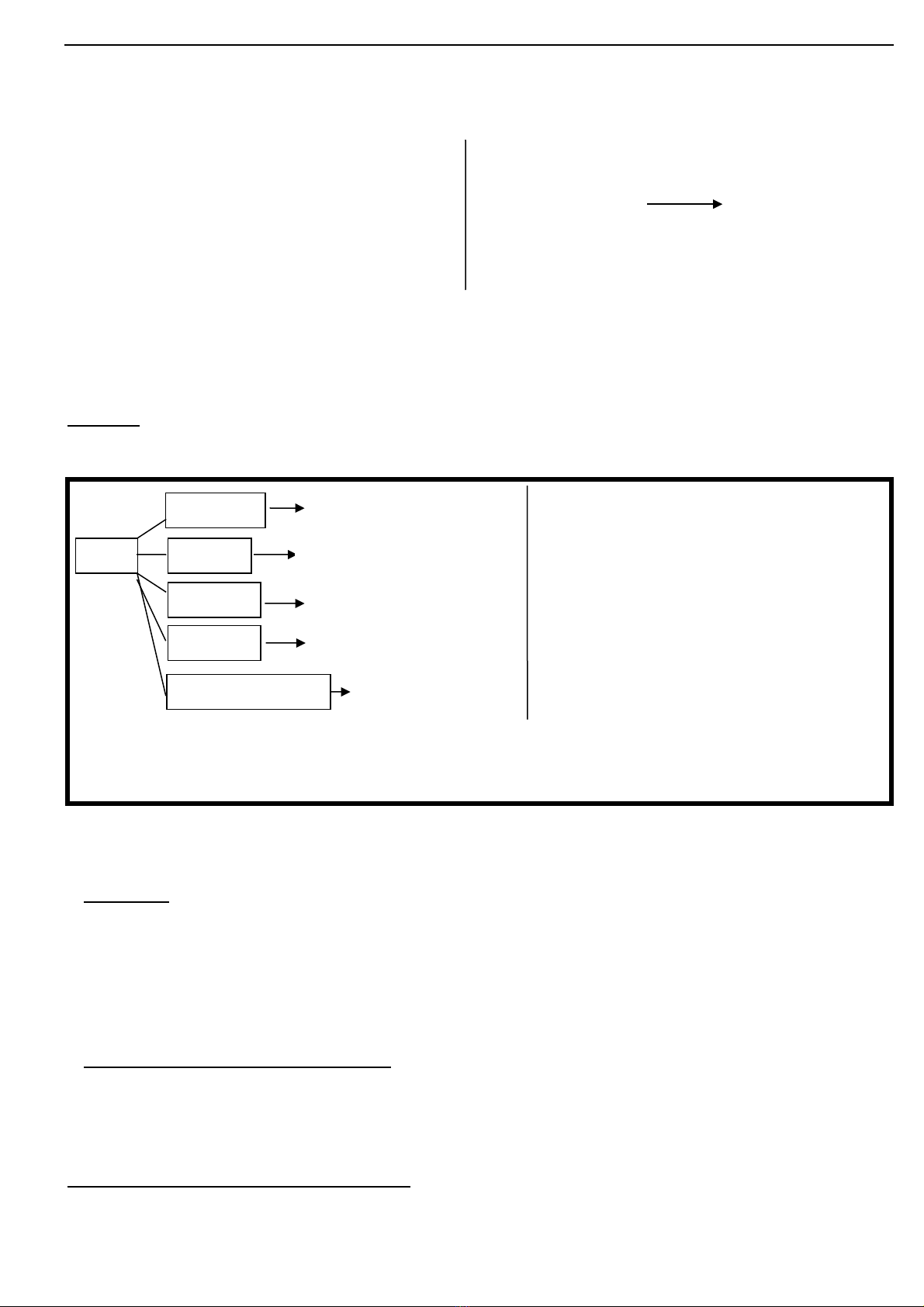
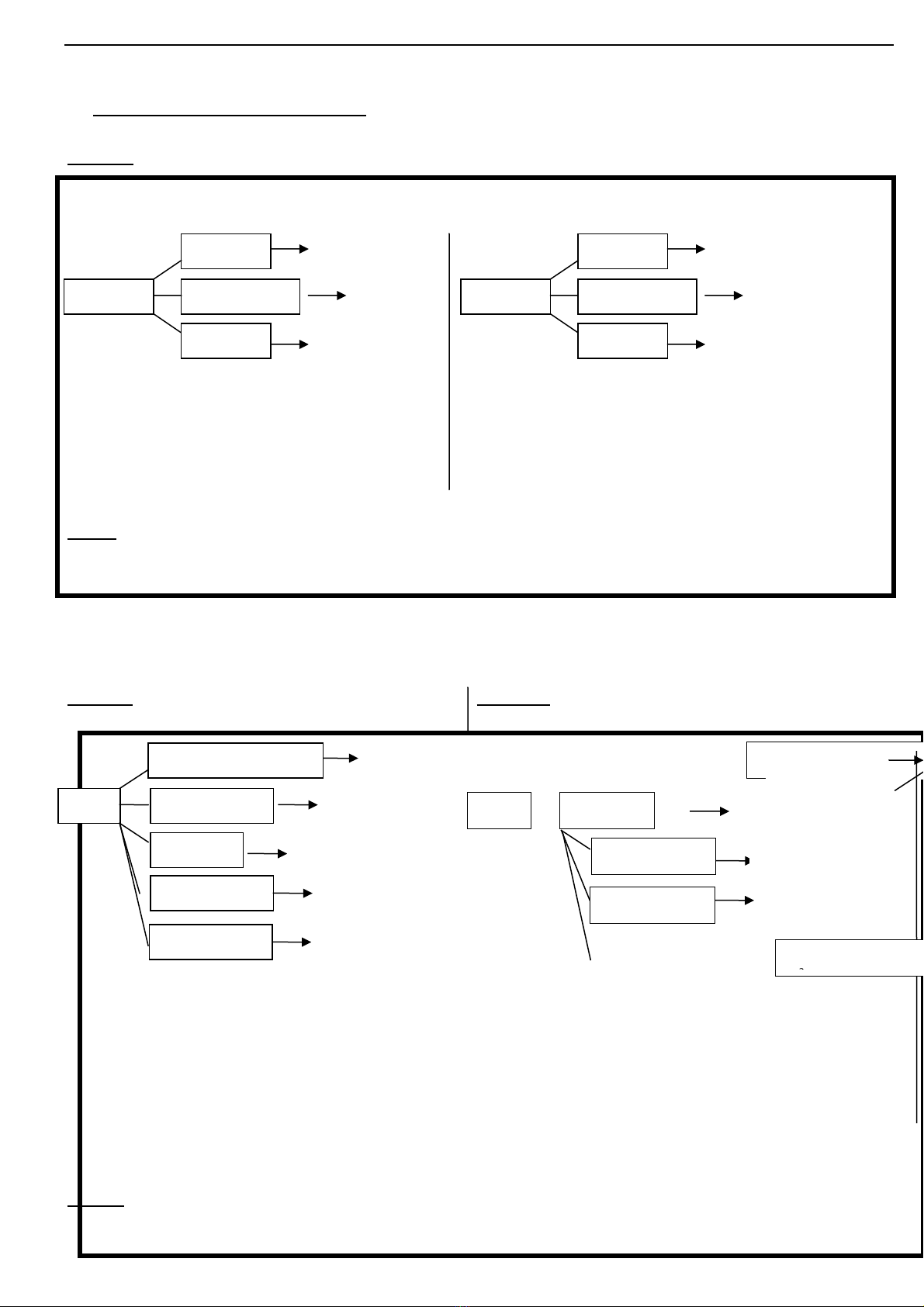
Tóm t t tính ch t hóa h c c a oxit axit và oxit baz theo s đ t duy:ắ ấ ọ ủ ơ ơ ồ ư
Vd: (1) SO2 + H2O H2SO3Vd: (4)CaO + H2O Ca(OH)2
SO3 + H2O H2SO4Na2O + H2O 2NaOH
(2) SO2 + Na2O Na2SO3 (5) CuO + 2HCl CuCl2 + H2O
CO2 + CaO CaCO3 CaO + H2SO4 CaSO4 + H2O
(3)CO2 + Ca(OH)2 CaCO3+ H2O (6) CaO + CO2 CaCO3
CO2 + Ba(OH)2 BaCO3 + H2O
L u ýư : M t s oxit bazộ ố ơ (Na2O, BaO, CaO, K2O, …) tác d ng v iụ ớ n c ướ còn các oxit baz nh :ơ ư MgO,
CuO, Al2O3, FeO, Fe2O3, … không tác d ng v i n cụ ớ ướ
Trong tr ng h p đ yêu c u nêu tính ch t hóa h c c a SOườ ợ ề ầ ấ ọ ủ 2 (hay CaO) thì các em vi t s đ t duyế ơ ồ ư
t ng t nh oxit axit (hay oxit baz ) trên.ươ ự ư ơ ở
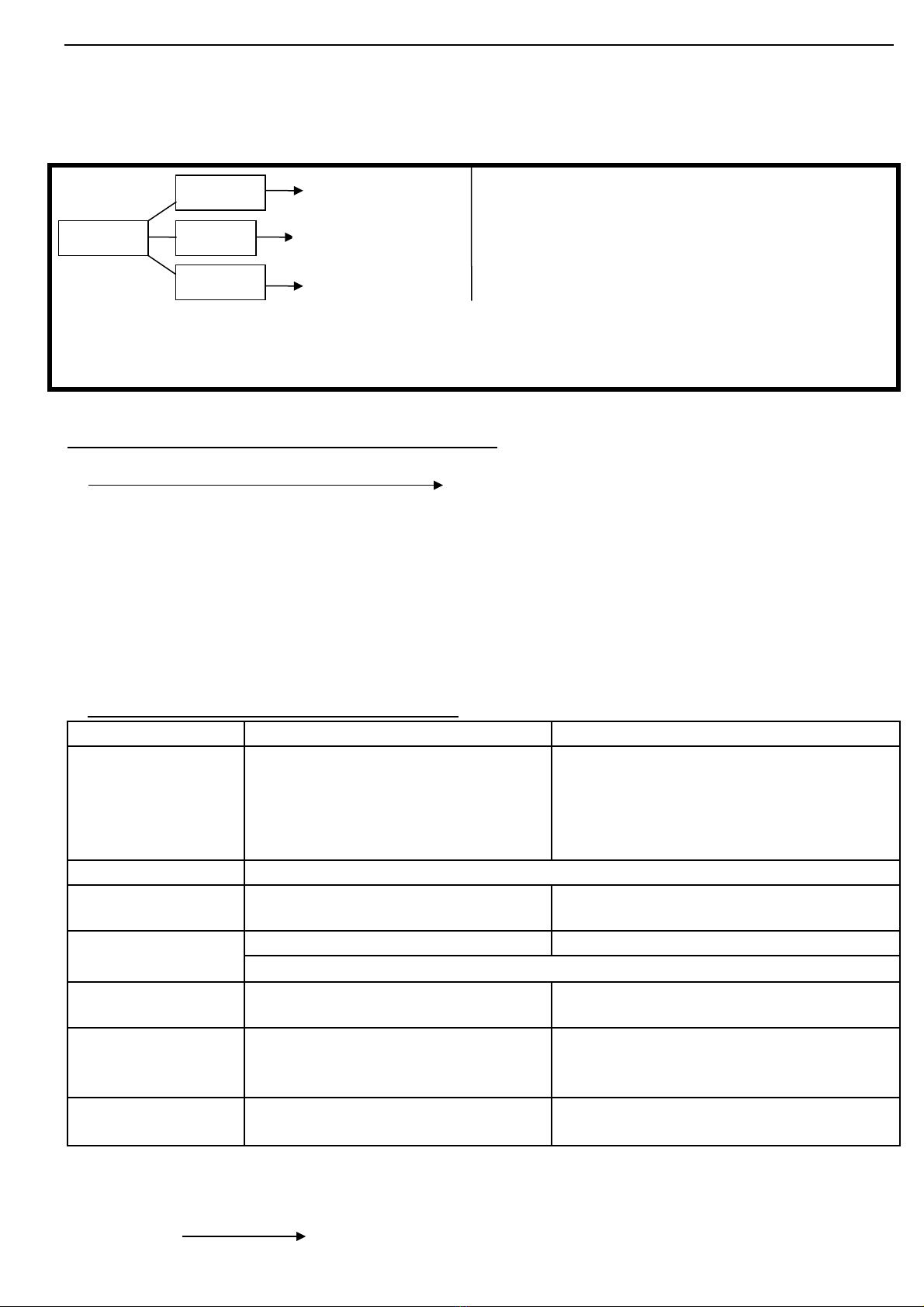
2. AXIT Vd: HCl, HNO3, H2SO4, H3PO4, … 3. BAZƠ Vd: KOH, NaOH, Ba(OH)2, Al(OH)3, …
Vd: (8) 2Al + 3H2SO4loãng Al2(SO4)3 +3H2 Vd: (12) NaOH + HCl NaCl + H2O
Zn + 2HCl ZnCl2 + H2 Ca(OH)2 + SO3 CaSO4 + H2O
(9) 3H2SO4 + 2Fe(OH)3 Fe2(SO4)3 + 6H2O (14) Ba(OH)2 + CuSO4 BaSO4 + Cu(OH)2
(10) H2SO4 + CaO CaSO4 + H2O 3NaOH + FeCl3 Fe(OH)3 + 3NaCl
(11) H2SO4 + BaCl2 BaSO4 + 2HCl (15) Cu(OH)2 CuO + H2O
2HCl + Na2CO3 2NaCl + H2O + CO2 chú ý: ch có baz không tan b nhi t phânỉ ơ ị ệ
h yủ
Chú ý:
- Axit ho c baz tác d ng v i mu i, đi u ki n x y ra ph n ng là s n ph m ph i có k t t a ho cặ ơ ụ ớ ố ề ệ ả ả ứ ả ẩ ả ế ủ ặ
ch t khí bay h i. Axit hay baz ph i tan.ấ ơ ơ ả
1
Oxit axit
+ N cướ Axit (1)
+ Oxit bazơ
+ Bazơ
Mu i ố
(2)
Mu i + n c (3)ố ướ
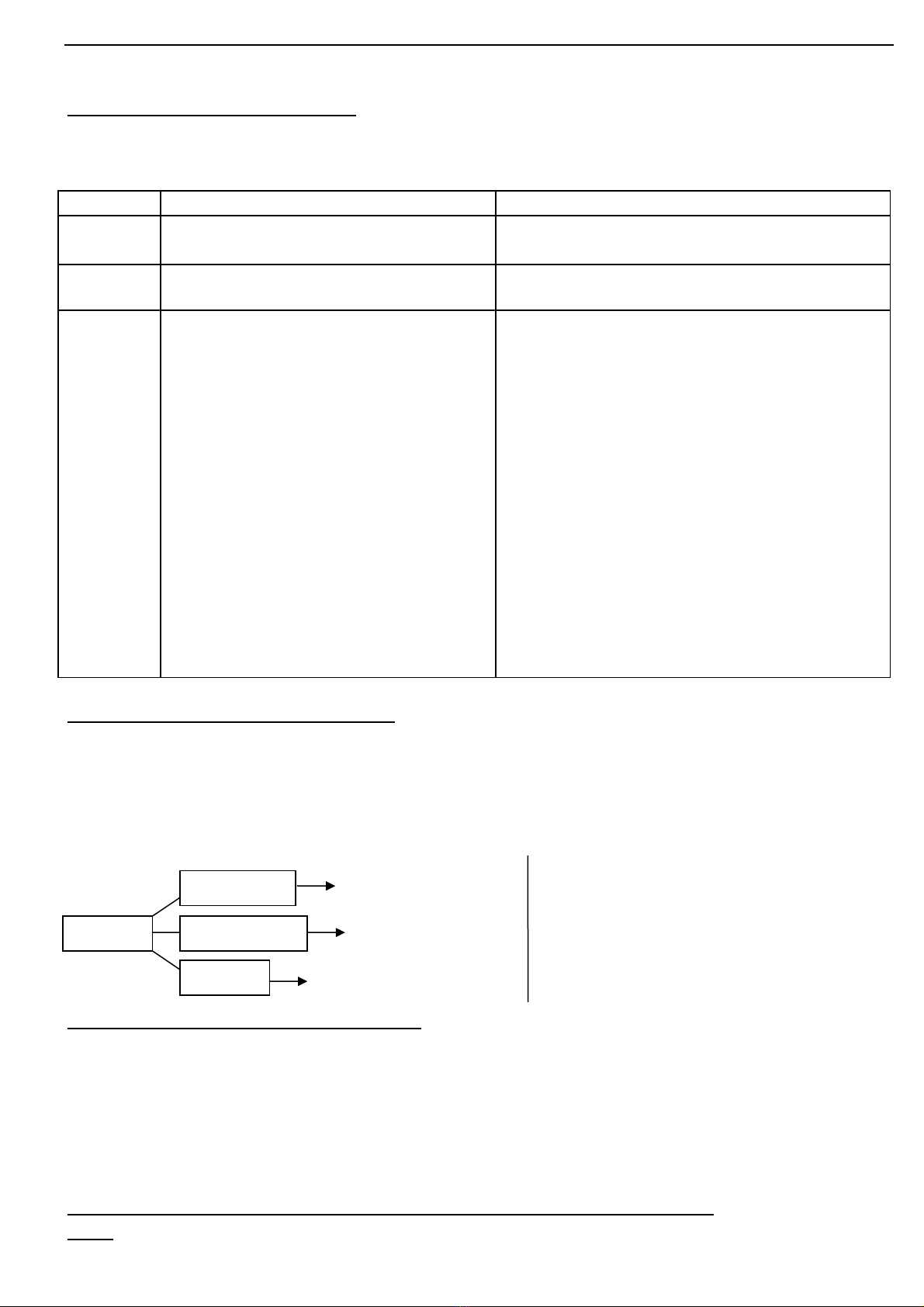
Oxit bz
+ N cướ Axit (4)
+ Oxit axit
+ Axit
Mu i ố
(5)
Mu i + n c (6)ố ướ
Baz ơ
+ Ch t ch th màuấ ỉ ị
Quì tím hóa xanh
+ Axit
Mu i + N c (13)ố ướ
+ Oxit axit
Mu i + bz m i (14)ố ớ
+ Mu iố
Mu i + n c (12)ố ướ
Oxit + n c (15)ướ
B nhi t phân ị ệ
h yủ
t0