UBND HUYỆN CHÂU THÀNH CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
TRƯỜNG THCS VĨNH KIM Độc lập - Tự do - Hạnh phúc
ĐỀ KIỂM TRA GIỮA HỌC KỲ I
Năm học: 2021-2022
Môn: Hóa học. Lớp 9
(Thời gian làm bài: 45 phút)
I. MỤC TIÊU
1. Kiến thức
- Chủ đề: Oxit, Axit, Bazơ và Muối
- Mối quan hệ giữa các loại hợp chất vô cơ.
2. Kĩ năng
- Nhận biết các chất, cách điều chế chất
- Biết giải bài tập tính theo PTHH (có chất dư), toán dạng hỗn hợp, toán tính nồng độ
dung dịch, ...
3. Thái độ
Cẩn thận, trung thực, kiên trì
4. Định hướng phát triển năng lực
- Năng lực tư duy
- Năng lực giải quyết vấn đề
- Năng lực tính toán
- Năng lực tự quản lí
II. HÌNH THỨC
- Trực tuyến
- Trắc nghiệm: 100%
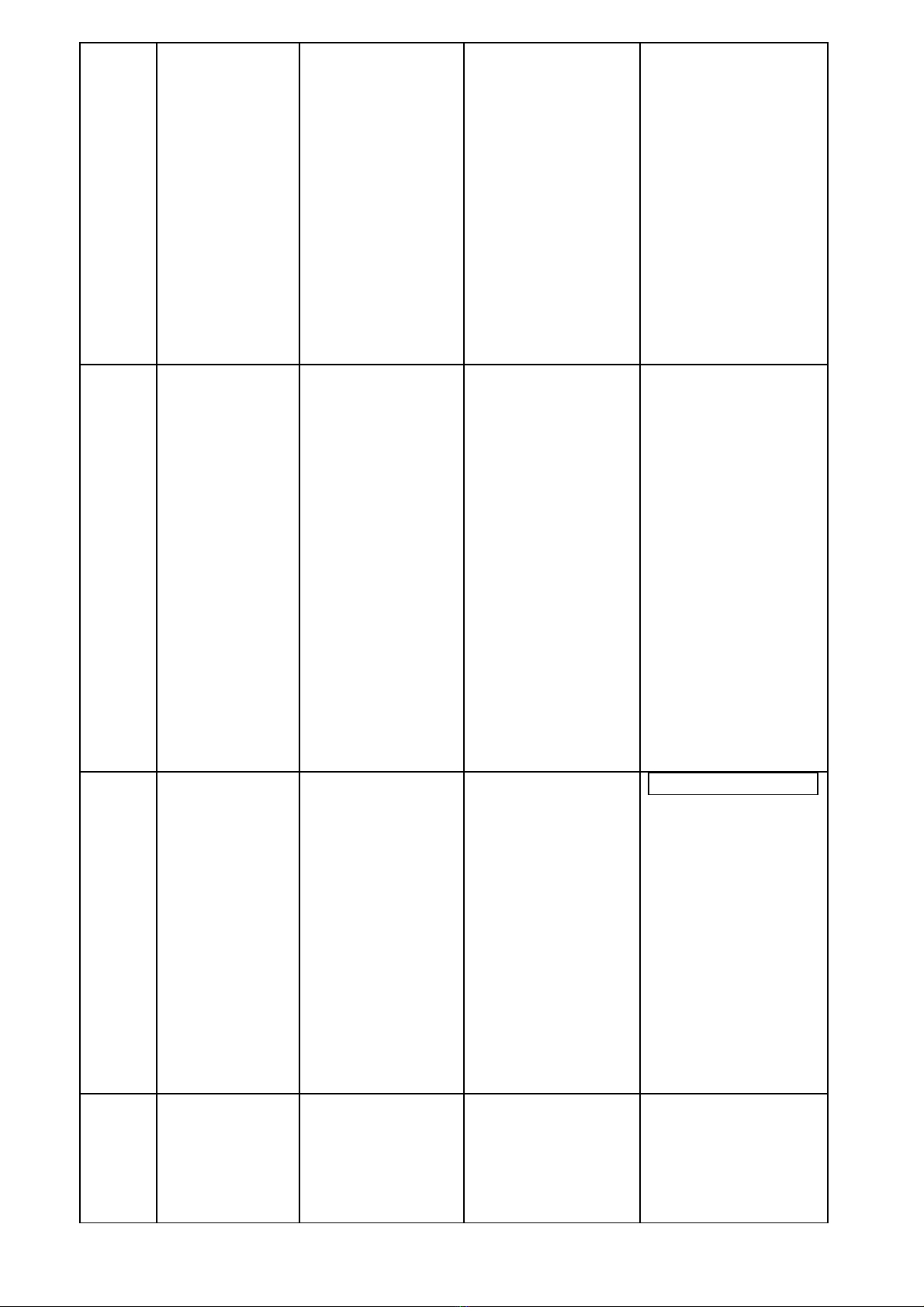
III. BẢNG MÔ TẢ CÁC MỨC ĐỘ NHẬN THỨC & CÂU HỎI, BÀI TẬP
NỘI
DUNG
KIẾN
THỨC
MỨC ĐỘ NHẬN THỨC
NHẬN BIẾT THÔNG HIỂU VẬN DỤNG THẤP VẬN DỤNG CAO
Oxit
- Nêu/nhận
ra/chỉ ra được:
+ Tính chất hoá
học của oxit
+ Sự phân loại
oxit
+ Tính chất, ứng
dụng, điều chế
canxi oxit và lưu
huỳnh đioxit.
- Quan sát thí và
rút ra TCHH của
oxit bazơ, oxit axit.
- Dự đoán, kiểm tra
và kết luận được về
TCHH của CaO,
SO2.
- Phân biệt được
một số oxit cụ thể.
- Giải thích được
các hiện tượng thí
nghiệm liên quan
đến TCHH của
oxit.
- Lựa chọn được hoá
chất, dụng cụ thí
nghiệm để nghiên
cứu tính chất hóa
học của oxit; đề
xuất được thí nghiệm
để kiểm chứng tính
TCHH của CaO,
SO2.
- Giải được các bài
tập đơn giản liên
quan đến tính chất
hóa học của oxit.
- Vận dụng tổng hợp
kiến thức, kỹ năng đã
học một cách linh
hoạt, sáng tạo để giải
quyết các tình
huống/vấn đề mới liên
quan tới oxit ,không
giống với tình huống /
vấn đề đã học; hoặc
HS phát hiện và giải
quyết được các vấn đề
liên quan đến thực tiễn
đời sống.
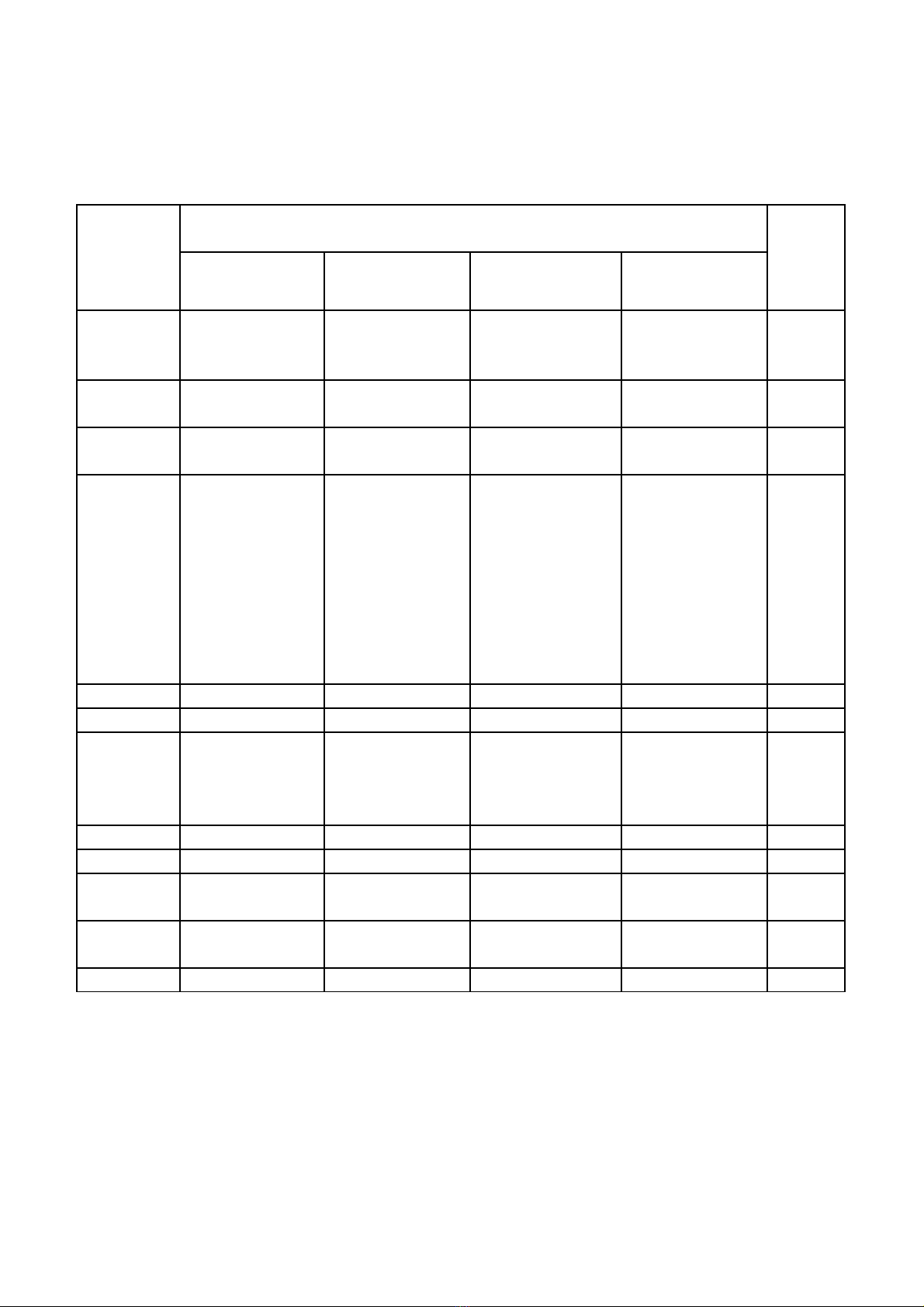
Axit + Tính chất hoá
học của axit
+ Ứng dụng,
cách nhận biết
axit HCl, H2SO4
- Quan sát thí
nghiệm và rút ra
kết luận về TCHH
của axit nói chung.
- Viết được PTHH
- Giải quyết được
các câu hỏi, bài tập
tương đối tổng hợp
liên quan đến tính
chất của axit, không
- Vận dụng tổng hợp
kiến thức, kỹ năng đã
học một cách linh
hoạt, sáng tạo để giải
quyết các tình