MA TRẬN ĐỀ KIỂM TRA GIỮA HỌC KÌ I- HÓA HỌC 9
Năm học 2023- 2024
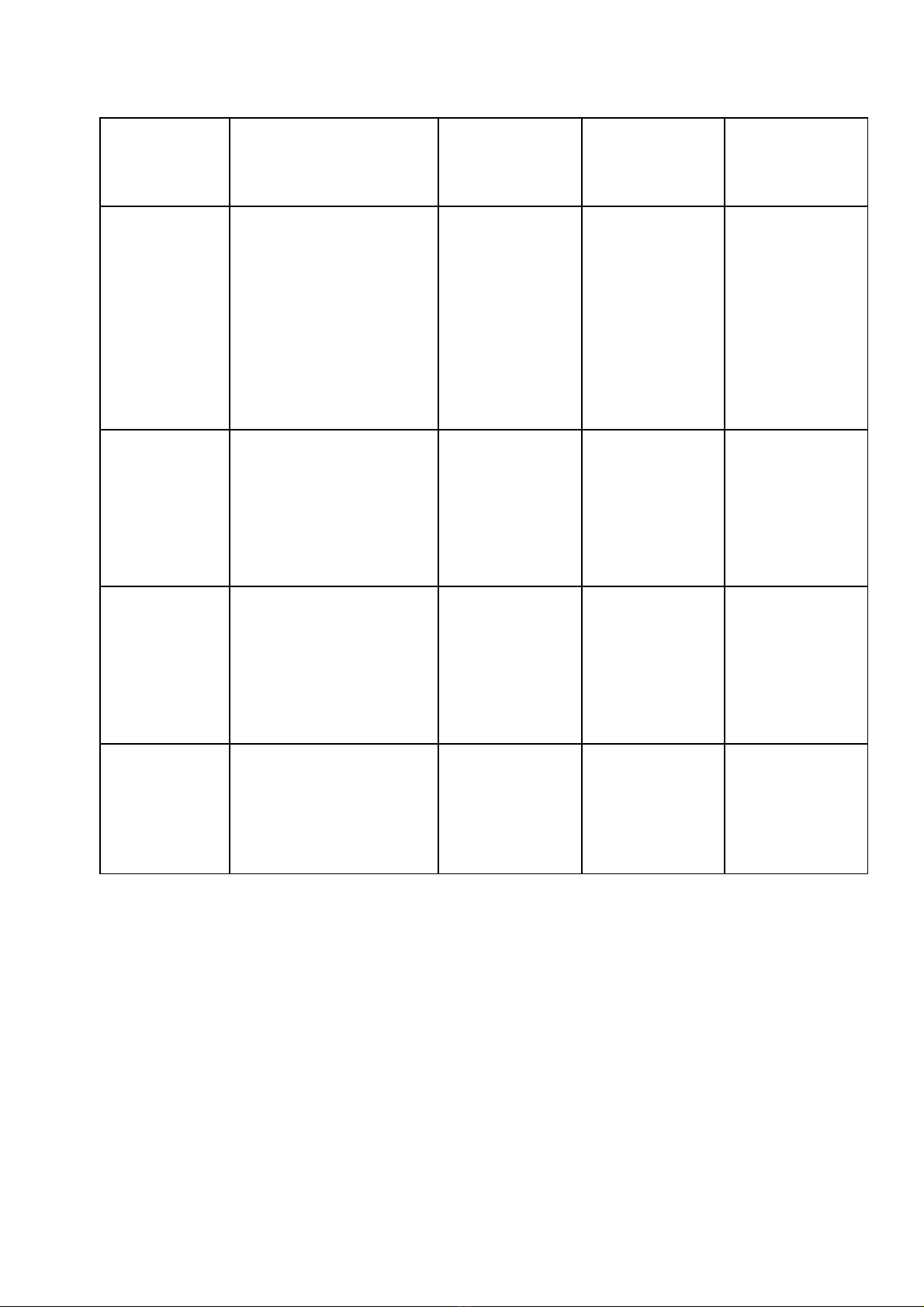
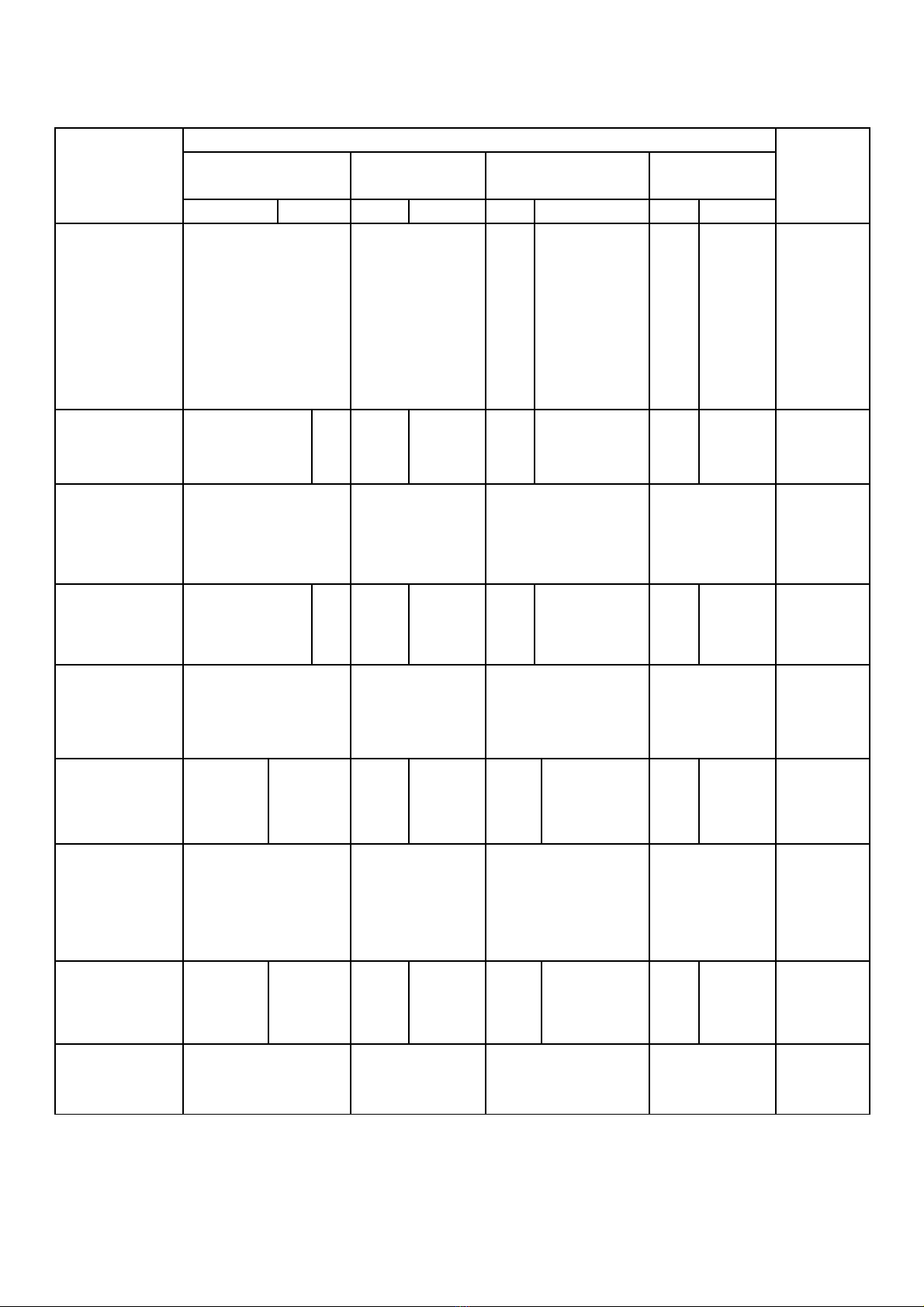
Chủ đề Mức độ nhận thức Tổng
cộng
Nhận biết Thông hiểu Vận dụng Vận dụng
cao
TN TL TN TL TN TL TN TL
1. Oxit - Tính chất hóa
học của oxit.
- Nguyên liệu
sản xuất oxit.
- Ứng dụng của
oxit.
- Tính chất
hóa học của
oxit.
- Viết các
PTHH thực
hiện dãy
chuyển hóa.
Số câu
Số điểm
Tỉ lệ
4
1,3đ
13%
1
0,4đ
4%
1
1,5đ
15%
6
3,2đ
32%
2. Axit - Tính chất hóa
học của axit
H2SO4.
- Viết PTHH
của phản ứng
xảy ra.
- Tính thể tích
hidro sinh ra ở
đktc.
Số câu
Số điểm
Tỉ lệ
3
1,0đ
10%
1/3
0,5đ
5%
1/3
1,0đ
10%
3 +2/3
2,5đ
25%
3. Bazơ - Tính chất hóa
học của bazơ.
- Thang pH.
- Ứng dụng
của bazơ.
Số câu
Số điểm
3
1,0đ
10%
1
0,3đ
3%
4
1,3đ
13%
4. Muối - Tính chất hóa
học của muối.
- Phản ứng trao
đổi.
- Tính chất
hóa học của
muối.
- Phân biệt dung
dịch.
- Tính C%
của chất tan
trong dung
dịch sau
phản ứng.
Số câu
Số điểm
Tỉ lệ
2
0,7đ
7%
1
0,3đ
3%
1
1,0đ
10%
1/3
1,0đ
10%
4 +1/3
3đ
30%
Tổng số câu
Số điểm
Tỉ lệ
12
4đ
40%
4 +1/3
3đ
30%
1+1/3
2,0đ
20%
1/3
1,0đ
10%
18
10,0đ
100%
BẢNG ĐĂC TẢ ĐỀ KIỂM TRA GIỮA HỌC KÌ I, NĂM HỌC 2023-2024