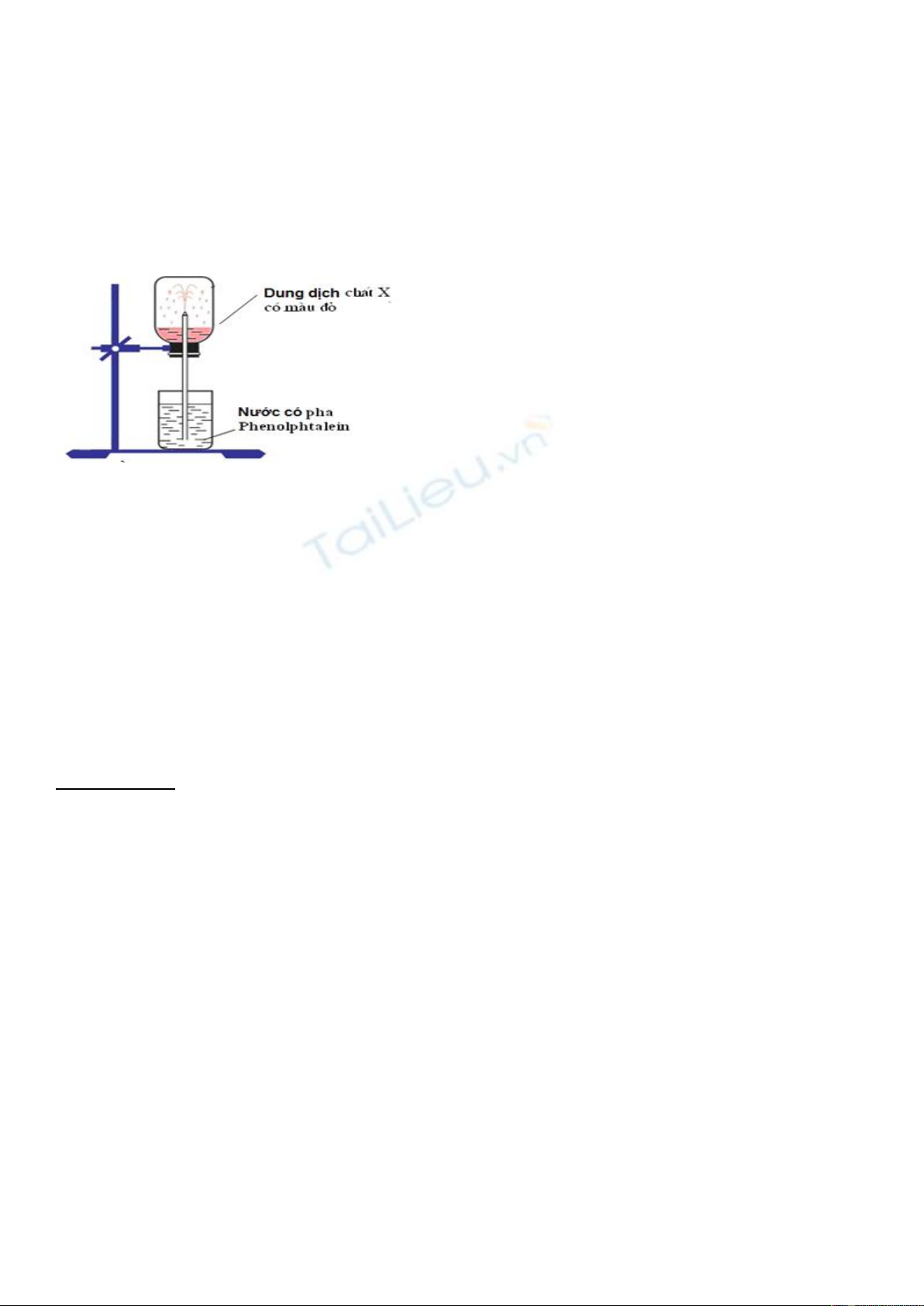
Trang 1/2 - Mã đề H01
SỞ GD & ĐT QUẢNG NAM
TRƯỜNG THPT HỒ NGHINH
KIỂM TRA GIỮA KÌ 1 – NĂM HỌC 2021 - 2022
MÔN HÓA HỌC - LỚP 11
Thời gian làm bài : 45 Phút
(Đề có 2 trang)
ĐỀ CHÍNH THỨC
Họ, tên: ............................................................... Lớp: ...................
I/ PHẦN TRẮC NGHIỆM KHÁCH QUAN: (7,00 điểm)
Câu 1: Chất điện li là chất khi tan trong nước
A. phân li hòan toàn thành ion. B. phân li một phần ra ion.
C. tạo dung dịch dẫn điện tốt. D. phân li ra ion.
Câu 2: Ở nhiệt độ thường, nitơ khá trơ về mặt hoạt động hóa học là do
A. nitơ có độ âm điện lớn nhất trong nhóm.
B. phân tử nitơ có liên kết ba khá bền.
C. nitơ có bán kính nguyên tử nhỏ.
D. phân tử nitơ không phân cực.
Câu 3: Cho phản ứng: Cu + HNO3loãng
0
t
Cu(NO3)2 + NO + H2O. Tổng hệ số các chất (số nguyên tối
giản nhất) trong phương trình trên là
A. 16. B. 10. C. 20. D. 12.
Câu 4: Số oxi hóa của N trong phân tử HNO3 là
A. +3. B. +5. C. -5. D. +4.
Câu 5: Cho dãy các chất: (NH4) 2SO4, NaCl, ZnCl2, FeCl3. Số chất trong dãy tác dụng với lượng dư dung
dịch Ba(OH)2 tạo thành kết tủa là
A. 3. B. 4. C. 2. D. 1.
Câu 6: Kim loại nào sau đây bị thụ động trong axit HNO3 đặc, nguội?
A. Cu. B. Al. C. Zn. D. Pb.
Câu 7: Một dung dịch có nồng độ [H+] = 3,0. 10-12 M. Dung dịch có môi trường
A. trung tính. B. bazơ. C. lưng tính. D. axit.
Câu 8: Dung dịch X có pH = 9, dung dịch Y có pH = 11. Phát biểu nào sau đây là đúng?
A. X có tính bazơ yếu hơn Y. B. Tính bazơ của X bằng Y.
C. X có tính bazơ mạnh hơn Y. D. X có tính axit yếu hơn Y.
Câu 9: Khi cho giấy quỳ tím ẩm vào bình chứa khí amoniac thì giấy quỳ
A. chuyển sang màu đỏ.
B. mất màu.
C. chuyển sang màu xanh.
D. không chuyển màu.
Câu 10: Theo thuyết Areniut, chất nào sau đây là bazơ?
A. NaOH. B. H2SO4. C. HCl. D. Na2SO4.
Câu 11: Chất nào sau đây thuộc loại chất điện li yếu?
A. HCl. B. NaCl. C. HF. D. KOH.
Câu 12: HNO3 chỉ thể hiện tính axit khi tác dụng với các chất thuộc dãy nào dưới đây?
A. CaCO3, Fe(OH)3, FeO. B. CuO, NaOH, FeCO3.
C. KOH, FeS, Cu(OH)2. D. Fe(OH)3, Na2CO3, Fe2O3.
Câu 13: Phương trình ion thu gọn: H+ + OH- → H2O, biểu diễn bản chất của phản ứng hoá học nào sau đây?
A. H2SO4 + BaCl2 → BaSO4 + 2HCl. B. NaOH + NaHCO3 → Na2CO3 + H2O.
C. 3HCl + Fe(OH)3 → FeCl3 + 3H2O. D. H2SO4 + 2KOH → K2SO4 + 2H2O.
Câu 14: Sản phẩm của phản ứng nhiệt phân hoàn toàn AgNO3 là
A. Ag, NO2, O2. B. Ag2O, NO, O2. C. Ag2O, NO2, O2. D. Ag, NO, O2.
Câu 15: Trong công nghiệp, phần lớn lượng nitơ sản xuất ra được dùng để
A. tổng hợp amoniac. B. làm môi trường trơ.
C. tổng hợp phân đạm. D. sản xuất axit nitric.
Câu 16: Muối axit là muối
Mã đề H01