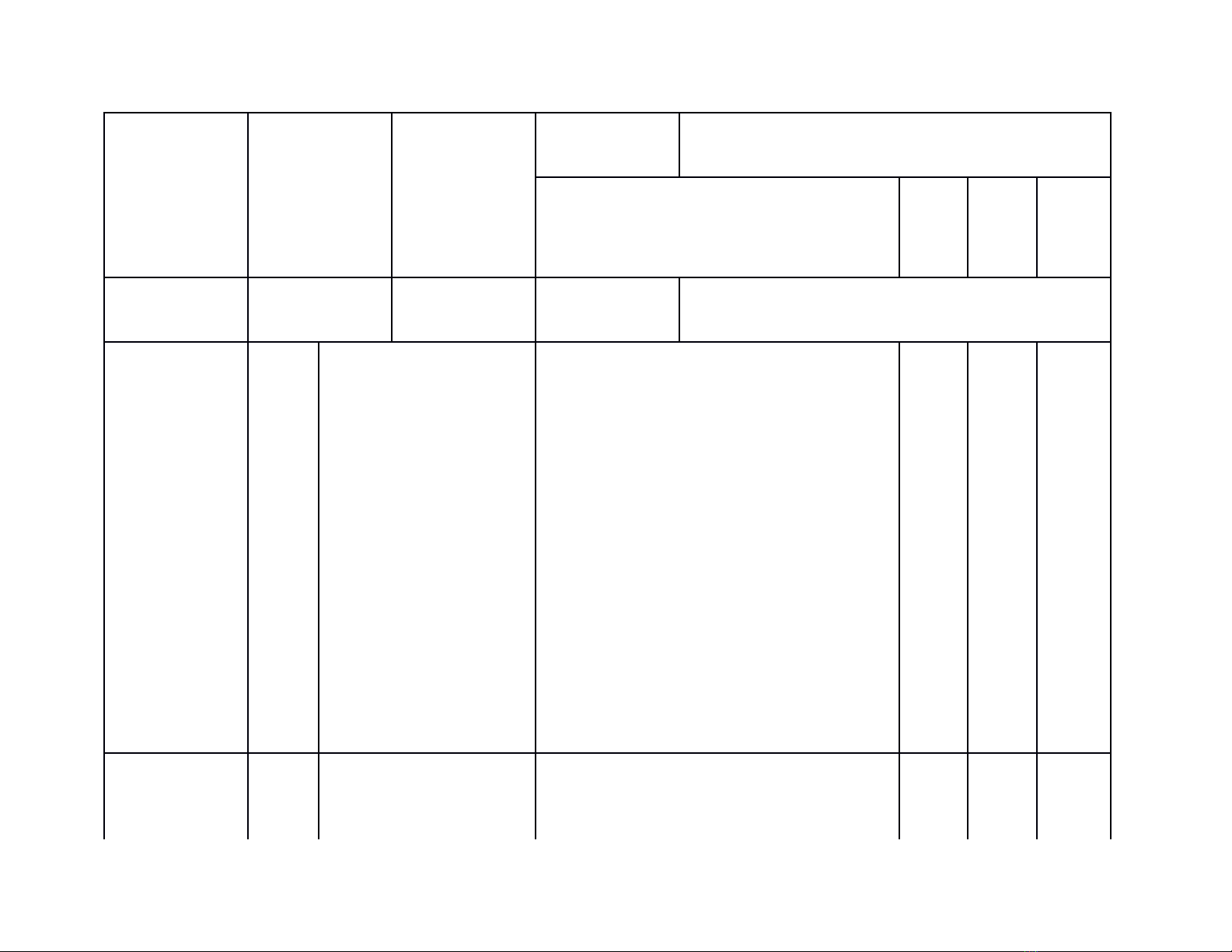
Pt:2 Fe + 3Cl2
2FeCl3
b. Clo tan trong nước tạo dung dịch nước clo làm quỳ tím ban đầu hoá đỏ do có axit
HCl, sau đó mất màu do HCl O
H2O + Cl2
HCl + HClO
0,5
Câu 3:
a+b
n axit = 0,2 X 1.5 = 0,3 (mol)
2Al + 3H2SO4
Al2(SO4)3 + 3 H2 (1)
Theo PT 2 3 1 3 (mol)
Theo bài 0,2 0,3 0,1 0,3 (mol)
nAl= 0,2 mol ; mAl= 0,2 x 27= 5.4g
b. mCu = 11.8 -5.4 = 6.4
nCu = 6.4 /64 = 0.1 Mol
Cu +Cl2
CuCl2
0, 5
0, 5
0, 25
0, 5