MA TRẬN KIỂM TRA CUỐI HỌC KÌ II NĂM HỌC 2023-2024
Môn: HÓA HỌC - LỚP 9
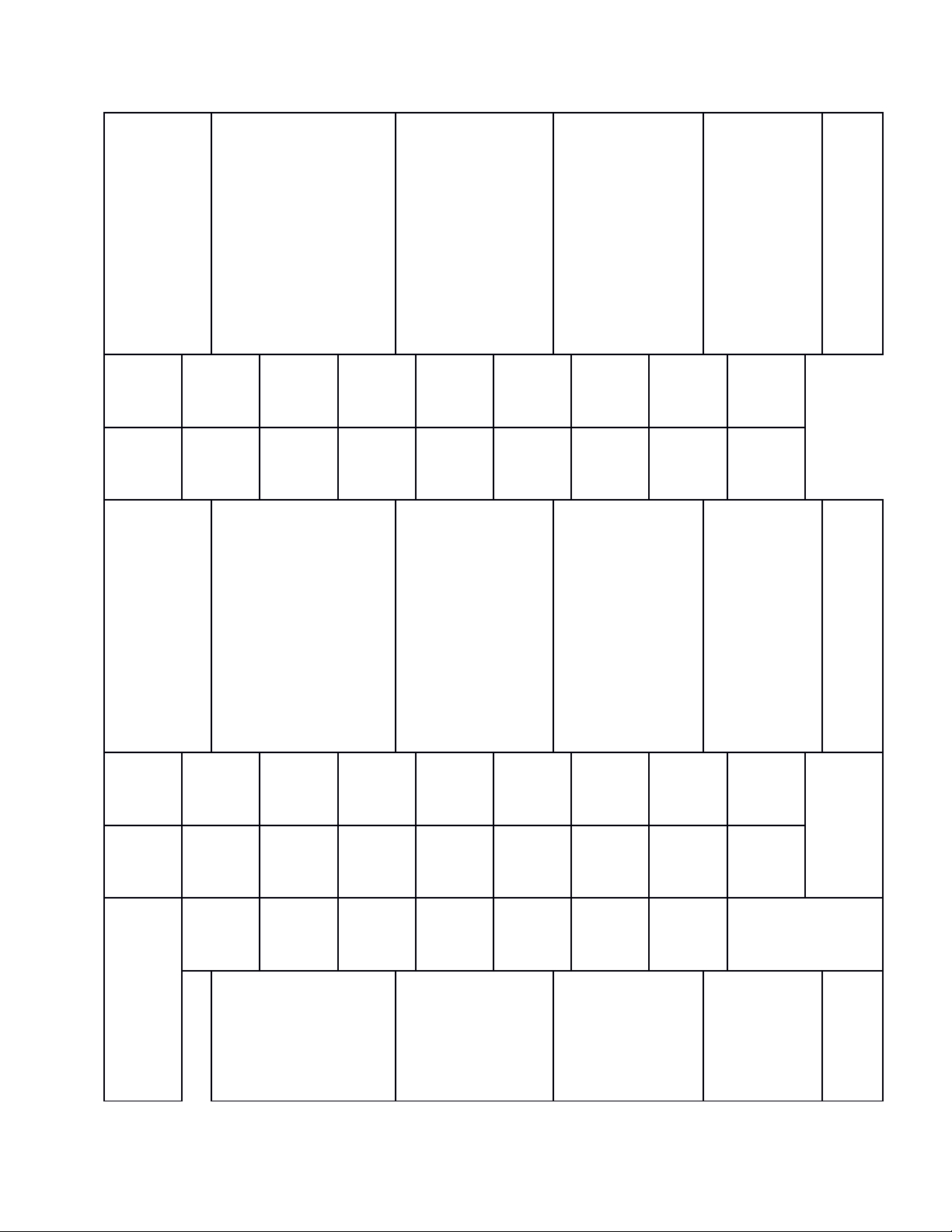
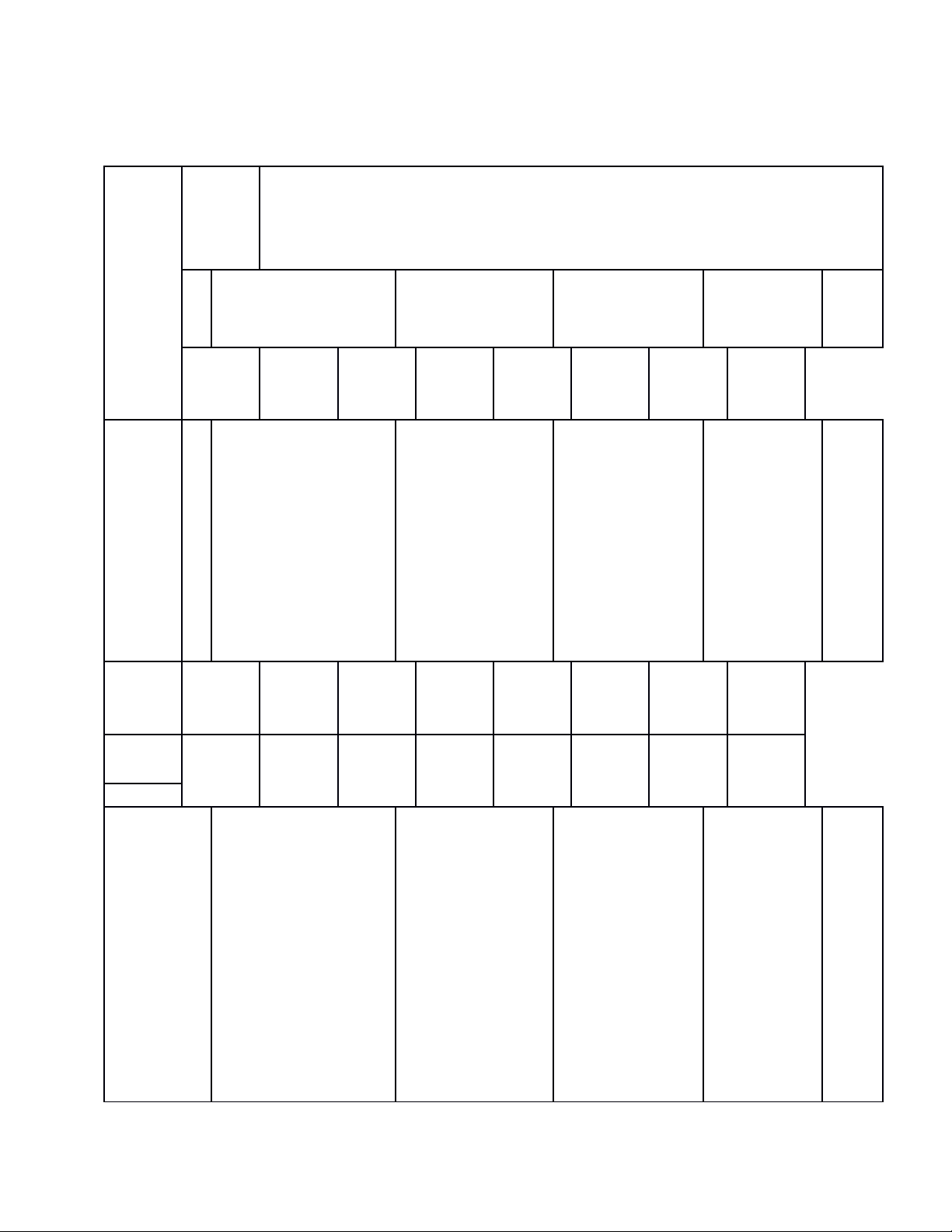
Nội
dung
Mức
độ
nhận
thức
Tổng
Nhận biết Thông hiểu Vận dụng
Vận dụng ở
mức cao
hơn
TN TL TN TL TN TL TN TL
CHƯƠNG
3: Phi kim
– Sơ lược
về bảng
tuần hoàn
các
NTHH.
- Biết được cấu tạo
bảng tuần hoàn: ô
nguyên tố, chu kì,
nhóm.
- Biết được sự biến
đổi tính chất của các
nguyên tố trong
bảng tuần hoàn.
- Dựa vào vị trí
của nguyên tố
trong bảng tuần
hoàn suy ra tính
chất hóa học của
nguyên tố đó và
ngược lại.
Vận dụng so
sánh tính chất
hóa học của một
nguyên tố với
các nguyên tố
lân cận, viết
phương trình
hóa học minh
họa.
3
Số câu 2 câu 1
Số
điểm
0,67 0,33
CHƯƠNG
4 :
Hiđrocacb
on – Nhiên
liệu.
- Nhận biết hợp chất
thuộc loại
hidrocacon haydẫn
xuất hidrocacbon.
- Biết được trạng
thái tự nhiên, cấu
tạo phân tử, tính
chất hóa học của
metan.
- Biết được cấu tạo
- Tính theo
PTHH.
- Tính chất của
các Hirocacbon.
- Viết PTHH
thực hiện dãy
chuyển hóa.
6