SỞ GIÁO DỤC VÀ ĐÀO TẠO KỲ THI CHỌN HỌC SINH GIỎI VÒNG TỈNH
KIÊN GIANG GIẢI TOÁN TRÊN MÁY TÍNH CASIO
------------ NĂM HỌC 2012 – 2013
---------------
ĐÁP ÁN MÔN THI: HÓA THPT
ĐỀ THI CHÍNH THỨC Thời gian làm bài: 120 phút (không kể thời gian giao đề)
Ngày thi: 01/11/2012
Câu 1:
1. X là nguyên tố thuộc nhóm A, hợp chất khí với hidro có dạng XH3. Electron cuối cùng trên
nguyên tử X có tổng 4 số lượng tử bằng 4,5.
a/ Xác định nguyên tố X, viết cấu hình electron của nguyên tử.
b/ Viết công thức cấu tạo, dự đoán trạng thái lai hoá của nguyên tử trung tâm trong phân tử XH3,
oxit bậc cao nhất, hidroxit bậc cao nhất của X.
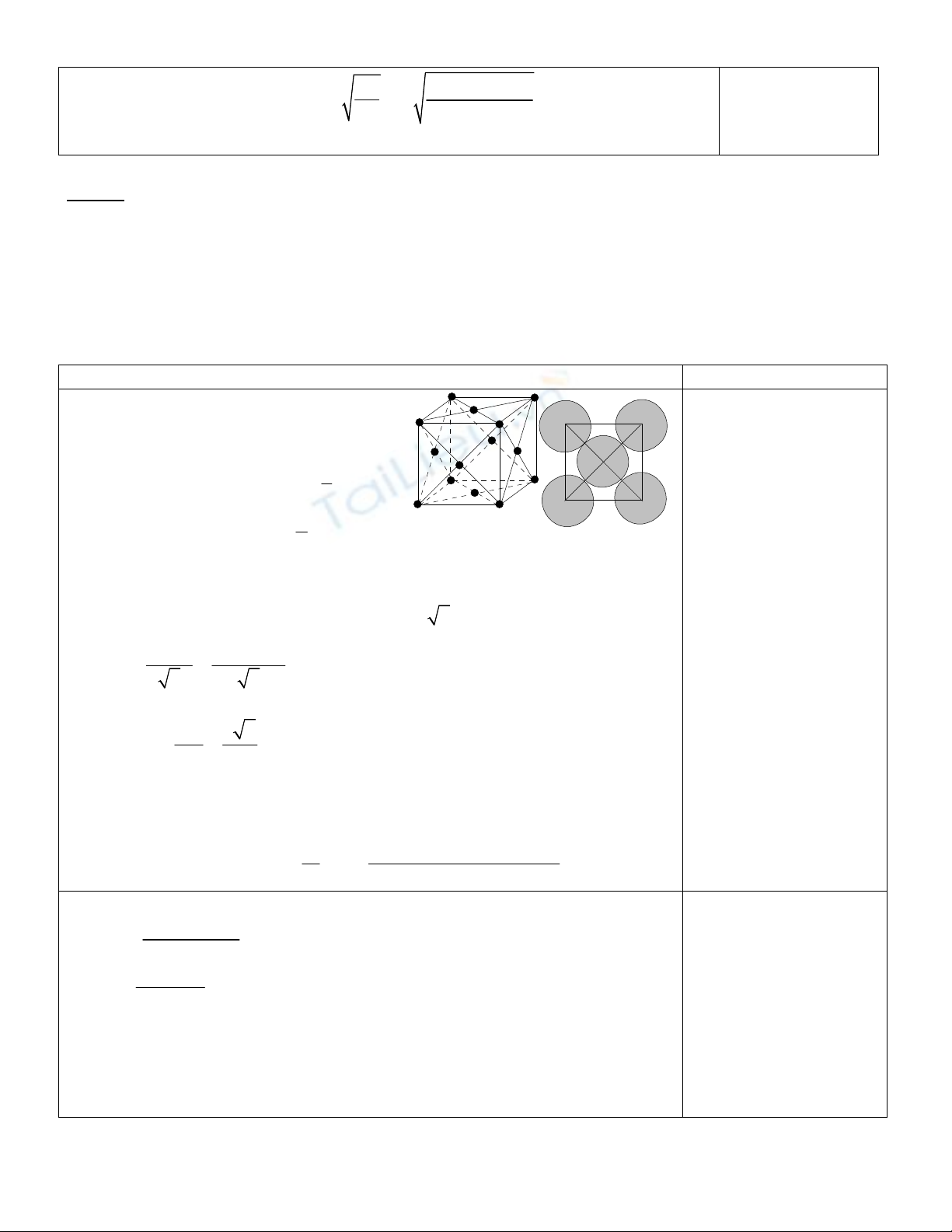
2. Tính bán kính nguyên tử gần đúng của Ca ở 200C, biết tại nhiệt độ đó khối lượng riêng của Ca
bằng 1,55 g/cm3. Giả thiết trong tinh thể các nguyên tử Ca có hình cầu, có độ đặc khít là 74%. Cho
nguyên tử khối của Ca = 40,08 Cách giải Kết quả
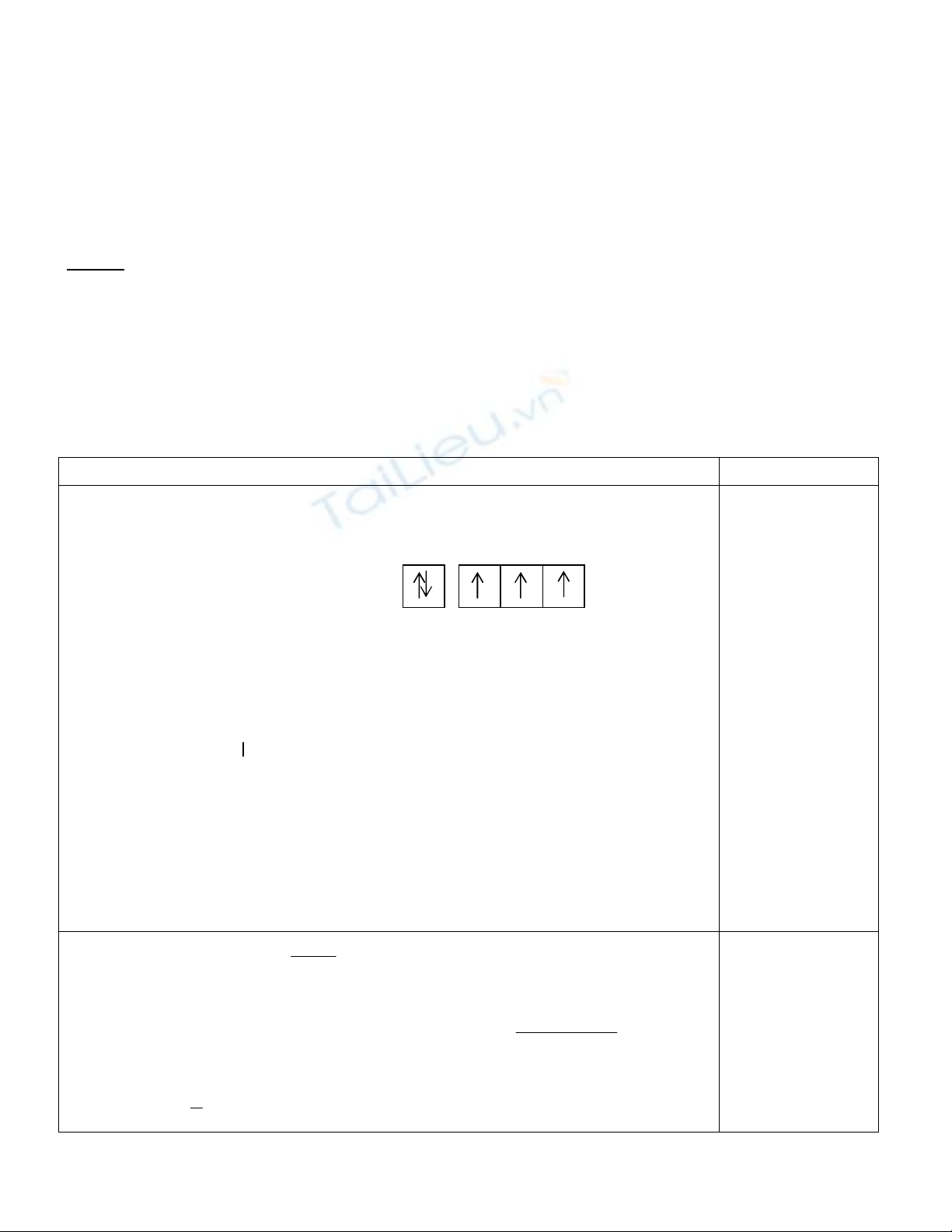
1.a) X là nguyên tố thuộc nhóm A và có hợp chất khí với hiđro có dạng XH3
X thuộc nhóm VA
Vậy cấu hình e của X ở lớp ngoài cùng là: ns2np3
Phân bố các e này vào obitan như sau:
Vậy e cuối cùng của X có bộ 4 số lượng tử như sau: n , l = 1 , m = +1 , s = +1/2
Mặt khác: n + l + m + s = 4,5 n = 2
Cấu hình e nguyên tử của X là: 1s22s22p3 ; X là Nitơ (N)
b) CTCT và trạng thái lai hóa của:
* NH3 N ở trạng thái lai hóa sp3
* Oxit cao nhất: N2O5 N ở trạng thái lai hóa sp2
* Hiđroxit cao nhất: HNO3 N ở trạng thái lai hóa sp2
a) 1s22s22p3
X là Nitơ (N)
(1,5 điểm)
b) N ở trạng thái
lai hóa sp3
( 1,5 điểm)
2. Thể tích của 1 mol Ca =
40,08
1,55
= 25,858 cm3
một mol Ca chứa NA = 6,02 1023 nguyên tử Ca
Theo độ đặc khít, thể tích của 1 nguyên tử Ca =
23
25,858 0,74
6,02 10
= 3,18
1023 cm3
Từ V =
3
4
r
3
1,965.10-8 cm
(2 điểm)
H – N – H
H
O = N – O – N = O
O O
H – O – N = O
O