S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
H I D NGẢ ƯƠ KÌ THI CH N H C SINH GI I T NHỌ Ọ Ỏ Ỉ
L p 12 THPT năm h c 2012 – 2013ớ ọ
Môn thi : Hóa h cọ
Th i gian làm bài: ờ180 phút
(Đ thi g m 02 trang)ề ồ
Câu I (2 đi m)ể
1. Nêu hi n t ng và vi t ph ng trình ph n ng trong các thí nghi m sau:ệ ượ ế ươ ả ứ ệ
a. S c khí Hụ2S vào dung d ch CuClị2.
b. Cho dung d ch Naị2CO3 vào dung d ch AlClị3.
c. Cho Fe3O4 vào dung d ch HI, sau đó cho vào dung d ch sau ph n ng m t ít h tinhị ị ả ứ ộ ồ
b t.ộ
d. Cho t t dung d ch NHừ ừ ị 3 đn d vào dung d ch CuSOế ư ị 4.
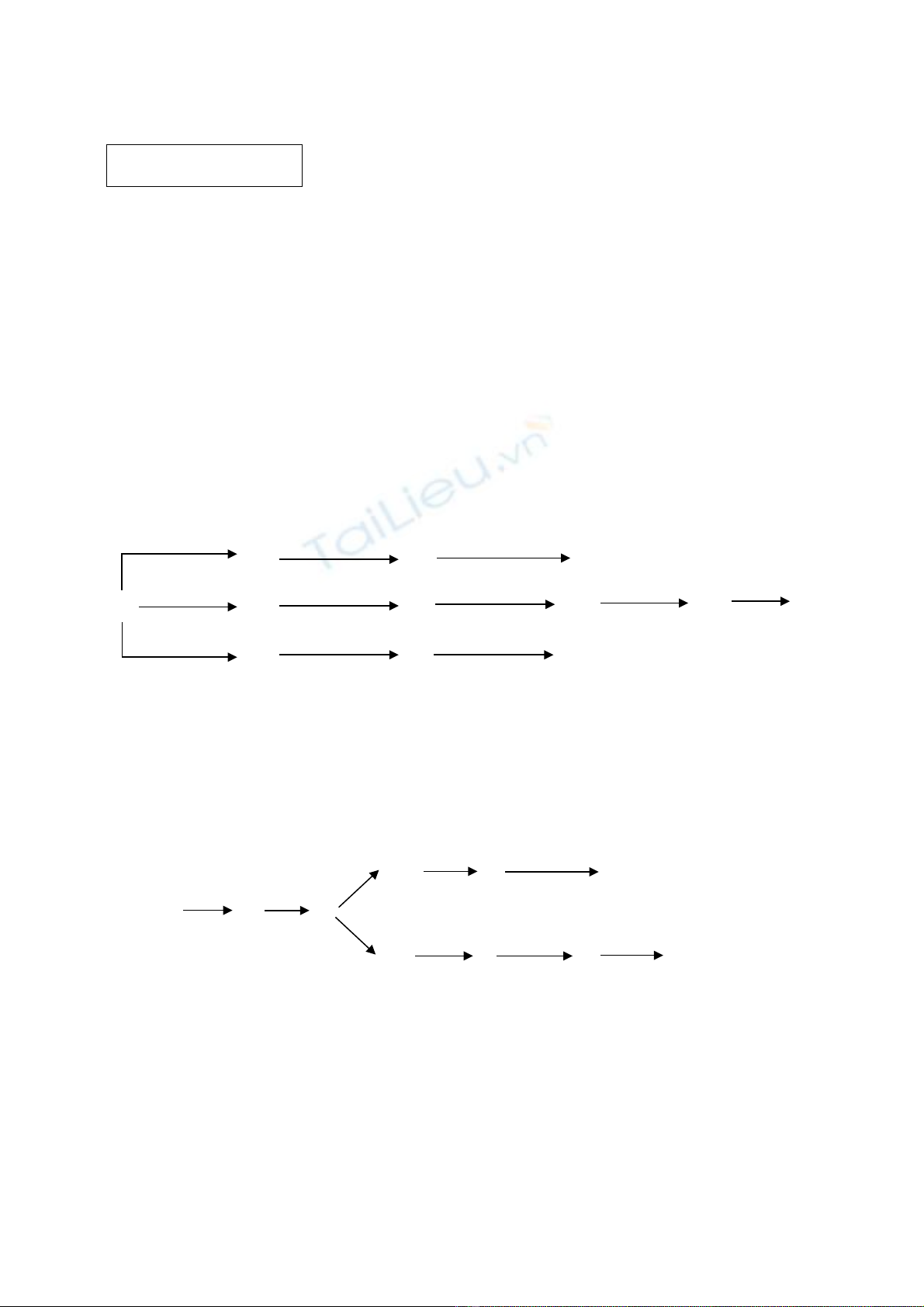
2. Xác đnh công th c các ch t và vi t ph ng trình ph n ng bi u di n theo s đị ứ ấ ế ươ ả ứ ể ễ ơ ồ
bi n hoá sau:ế
Câu II (2 đi m)ể
1. Cho h n h p X g m Glyxin và Alanin tham gia ph n ng đi u ki n thích h p thuỗ ợ ồ ả ứ ở ề ệ ợ
đc các s n ph m đipeptit. Vi t ph ng trình ph n ng và g i tên s n ph m t oượ ả ẩ ế ươ ả ứ ọ ả ẩ ạ
thành.
2. Cho dãy bi n hoá sau:ế
Xác đnh các ch t A, B, C, D, E, F, G và vi t các ph ng trình ph n ng (ghi rõị ấ ế ươ ả ứ
đi u ki n n u có).ề ệ ế
Câu III (2 đi m)ể
1. Cho h n h p X g m FeCOỗ ợ ồ 3, FeS2 tác d ng v a đ v i dung d ch HNOụ ừ ủ ớ ị 3 đc, nóngặ
thu đc dung d ch Y (ch a Fe(NOượ ị ứ 3)3; H2SO4) và 22,4 lít h n h p khí Z g m hai khíỗ ợ ồ
(đktc). Pha loãng dung d ch Y b ng n c c t đ thu đc 2 lít dung d ch có pH = 1.ị ằ ướ ấ ể ượ ị
a. Vi t ph ng trình ph n ng và tính kh i l ng h n h p X.ế ươ ả ứ ố ượ ỗ ợ
1
Đ CHÍNH TH CỀ Ứ
Al4C3
E
A B
C D
G
FCao su Buna
polivinylancol
X+ Fe, t0
+ H2, t0
+ H2O
Y
K
Y
+ A
+ A
+ D, t0
Z
L
X
+ H2SO4 + Q X
t0M
Z + P + H2O
+ A
+ B Fe + Y N