UBND T NH THÁI NGUYÊNỈ
S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ Đ THI KÌ THI CH N H C SINH GI I T NH Ề Ọ Ọ Ỏ Ỉ
NĂM H C 2010-2011Ọ
MÔN THI: HOÁ H C L P 12 (VÒNG 1 )Ọ Ớ
(Th i gian làm bài 180 phút không k th i gian giaoờ ể ờ
đ)ề
Câu I. (3,0 đi m)ể
Hòa tan h n h p r n (g m Zn, FeCOỗ ợ ắ ồ 3, Ag) b ng dd HNOằ3 (loãng, d ) thu đc h n h pư ượ ỗ ợ
khí A g m 2 khí không màu có t kh i so v i hiđro là 19,2 và dung d ch B. Cho B ph n ngồ ỉ ố ớ ị ả ứ
v i dung d ch NaOH d , l c k t t a t o thành và nung đn kh i l ng không đi đcớ ị ư ọ ế ủ ạ ế ố ượ ổ ượ
2,82 gam ch t r n. Bi t r ng m i ch t trong h n h p ch kh HNOấ ắ ế ằ ỗ ấ ỗ ợ ỉ ử 3 t o thành m t ch t.ạ ộ ấ
1. L p lu n đ tìm khí đã cho.ậ ậ ể
2. Tính kh i l ng m i ch t trong h n h p ban đu (bi t trong h n h p s mol Zn = số ượ ỗ ấ ỗ ợ ầ ế ỗ ợ ố ố
mol FeCO3).
CâuII. (4,0 đi m)ể
1. Cho 10,40 gam h n h p X (g m Fe, FeS, FeSỗ ợ ồ 2, S) tác d ng v i dung d ch HNOụ ớ ị 3 đcặ
nóng d thu đc V lít khí NOư ượ 2 (là s n ph m kh duy nh t, đo đktc) và dung d ch A. Choả ẩ ử ấ ở ị
A tác d ng v i dung d ch Ba(OH)ụ ớ ị 2 d thu đc 45,65 gam k t t a. ư ượ ế ủ
a) Vi t các ph ng trình hoá h c c a các ph n ng x y ra d i d ng ph ng trình ion.ế ươ ọ ủ ả ứ ả ướ ạ ươ
b) Tính V và s mol HNOố3 trong dung d ch c n dùng đ oxi hóa hoàn toàn h n h p X.ị ầ ể ỗ ợ
2. Cho ph n ng sau đây x y ra Tả ứ ả ở 0K: 2N2O5 (k)
タ
4NO2 (k) + O2 (k)
L n l t th c hi n các thí nghi m sau:ầ ượ ự ệ ệ
Thí nghi m 1: L y ệ ấ
2 5
N O
C 0,17mol / l=
; t c đ phân hu Vố ộ ỷ 1=1,39.10-3mol/s.
Thí nghi m 2: L y ệ ấ
2 5
N O
C 0,34mol / l=
; t c đ phân hu Vố ộ ỷ 2=2,78.10-3mol/s.
Thí nghi m 3: L y ệ ấ
2 5
N O
C 0,68mol / l=
; t c đ phân hu Vố ộ ỷ 3=5,56.10-3mol/s.
a) Vi t bi u th c tính t c đ c a ph n ng theo th c nghi m.ế ể ứ ố ộ ủ ả ứ ự ệ
b) Tính h ng s t c đ Tằ ố ố ộ ở 0K.
CâuIII. (4,0 đi m)ể
1. Nguyên t c a nguyên t A có t ng s h t c b n là 60, trong h t nhân s h t mangử ủ ố ổ ố ạ ơ ả ạ ố ạ
đi n b ng s h t không mang đi n. Nguyên t c a nguyên t D có 11 electron p. Nguyên tệ ằ ố ạ ệ ử ủ ố ử
nguyên t E có 4 l p electron và 6 electron đc thân. ố ớ ộ
a) D a trên c u hình electron, cho bi t v trí c a các nguyên t trên trong b ng h th ng tu nự ấ ế ị ủ ố ả ệ ố ầ
hoàn.
b) So sánh (có gi i thích) bán kính c a các nguyên t và ion A, Aả ủ ử 2+ và D -.
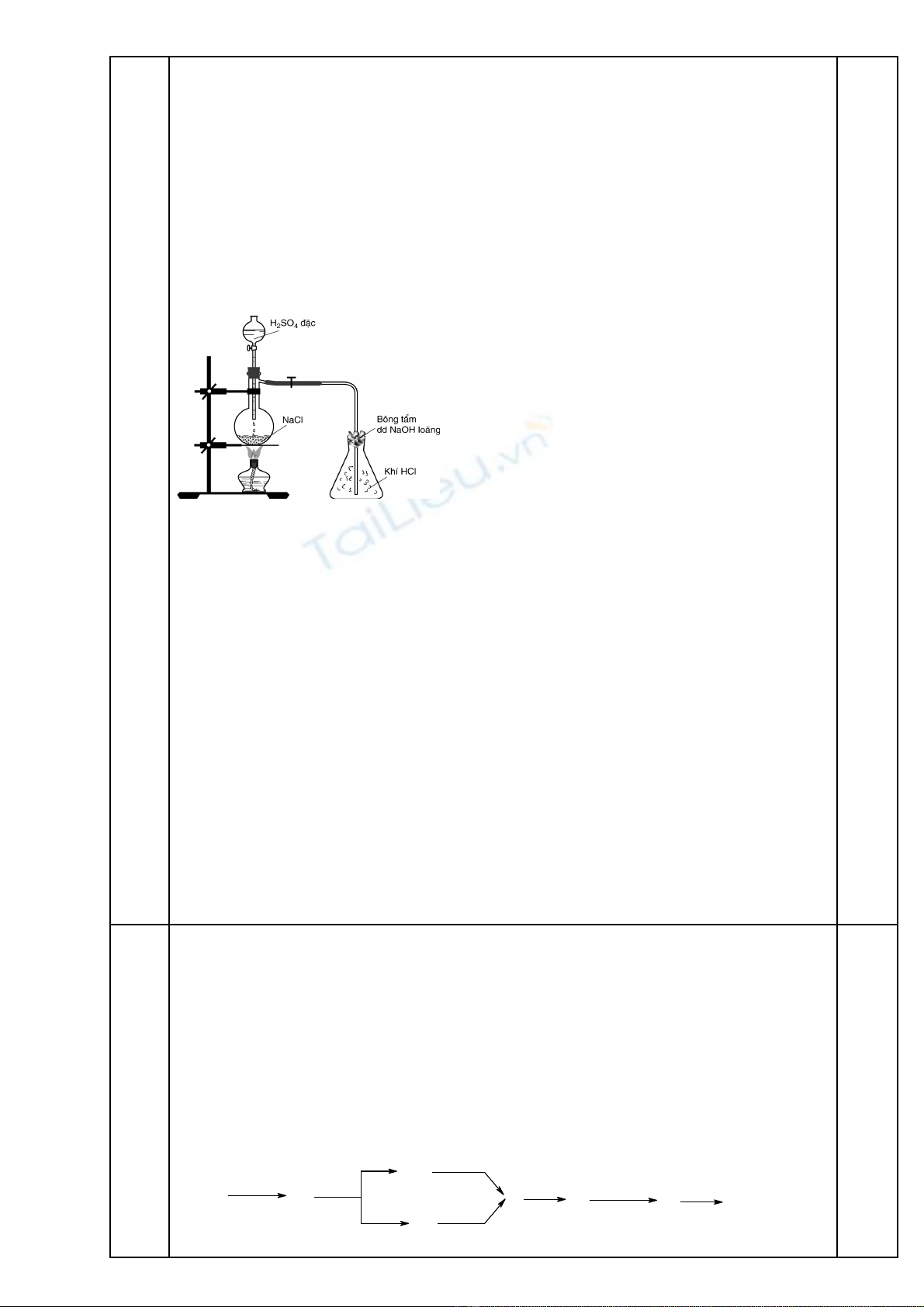
2. V hình mô t cách ti n hành thí nghi m đi u ch HCl b ng nh ng hóa ch t và d ng cẽ ả ế ệ ề ế ằ ữ ấ ụ ụ
đn gi n có s n trong phòng thí nghi m sao cho an toàn. Ghi rõ các chú thích c n thi t.ơ ả ẵ ệ ầ ế
3. S c khí Clụ2 vào dung d ch NaOH loãng thu đc dung d ch A, hòa tan Iị ượ ị 2 vào dung d chị
NaOH loãng thu đc dung d ch B (các thí nghi m đc ti n hành nhi t đ phòng). ượ ị ệ ượ ế ở ệ ộ
a) Vi t ph ng trình hóa h c c a các ph n ng x y ra và cho nh n xét.ế ươ ọ ủ ả ứ ả ậ
b) Nêu hi n t ng và vi t ph ng trình hóa h c các ph n ng x y ra khi cho l n l t cácệ ượ ế ươ ọ ả ứ ả ầ ượ
dung d ch h n h p HCl và FeClị ỗ ợ 2, dung d ch Brị2, H2O2 vào dung d ch A (không có Clị2 d ).ư
Câu IV. (2,5 đi m)ể
ĐỀ CHÍNH THỨC