S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
TUYÊN QUANG
K THI CH N H C SINH GI IỲ Ọ Ọ Ỏ
C P T NH L P 12 THPT NĂM H C 2010-2011Ấ Ỉ Ớ Ọ
MÔN: HOA HOC
Th i gian làm bài: 180 phút. ờ
(Không k th i gian giao để ờ ề)
Đê thi nay co 02 trang
Câu 1: (4,5 điêm)
1. Môt h p chât Y co dang AB ơ 3, tông sô hat proton trong phân t la 40. Trong thanh phân hat ư
nhân cua A cung nh B đêu co sô hat proton băng sô hat notron. A thuôc chu ky 3 bang hê ư
thông tuân hoan.
a) Hay xac đinh tên goi cua A, B.
b) Cho biêt tinh chât hoa hoc đăc tr ng cua h p chât AB ư ơ 3 (viêt ph ng trinh phan ng minh hoa). ươ ư
2. Dung dich A gôm cac chât tan FeCl 3, AlCl3, NH4Cl va CuCl2 (nông đô môi chât xâp xi 0,1M).
a) Dung dich A co phan ng axit, baz , trung tinh? Tai sao? ư ơ
b) Cho H2S lôi châm qua dung dich A cho đên bao hoa thi thu đc kêt tua va dung dich B. Hay ươ
cho biêt thanh phân cac chât trong kêt tua va trong dung dich B.
c) Thêm dân NH3 vao dung dich B cho đên d . Co hiên t ng gi xay ra ư ươ ? Viêt cac ph ng trinh ươ
phan ng ion đê giai thich. ư
Câu 2: (2,0 điêm)
Cho cân băng sau:H2 (k) + Br2(k) 2 HBr (k) (1)
a) Khi khao sat phan ng tai hai nhiêt đô T ư 1 va T2 ma T1<T2, thây hăng sô cân băng hoa hoc
(cbhh) theo nông đô co tri sô t ng ng la K ươ ư 1, K2 ma K1>K2. Phan ng nay toa nhiêt hay thu ư
nhiêt. Giai thich.
b) Tai nhiêt đô 1024 0C, phan ng (1) co K= 1,6.10 ư 5. Hay tinh tri sô hăng sô cbhh cua phan ng: ư
1/2 H2 (k) + 1/2 Br2 (k) HBr (k) tai nhiêt đô nay. S thay đôi tri sô hăng sô cbhh đo co y ơ ư
nghia hoa hoc hay không, giai thich.
c) Cho môt l ng HBr nguyên chât vao binh kin co thê tich cô đinh rôi đa nhiêt đô t i ươ ư ơ
10240C. Hay tinh ty lê HBr bi phân huy tai 1024 0C (theo ph ng trinh (1)). Cho nhân xet vê kêt ươ
qua đo.
Câu 3:(3,5 điêm)
1. Trôn ba dung dich H 2SO4 0,1M, HNO3 0,2M, HCl 0,3M v i nh ng thê tich băng nhau thu ơ ư
đc dung dich A. Lây 300 ml dung dich A cho tac dung v i môt dung dich B gôm NaOH ươ ơ
0,2M va KOH 0,29 M. Tinh thê tich dung dich B cân dung đê sau khi tac dung v i 300 ml dung ơ
dich A đc dung dich co pH= 2. ươ
2. Cho 12,45 gam hôn h p A gôm kim loai M co hoa tri II va nhôm tac dung v i dung dich ơ ơ
HNO3 d thu đc 1,12 lit hôn h p 2 khi (N ư ươ ơ 2O, N2) co ty khôi h i đôi v i hidro băng 18,8 va ơ ơ
dung dich B. Cho B tac dung v i dung dich NaOH d thu đc 0,448 lit khi NH ơ ư ươ 3. Xac đinh kim
loai M va khôi l ng môi kim loai trong hôn h p A. Biêt n ươ ơ A = 0,25 mol, cac khi đêu đo điêu ơ
kiên tiêu chuân.
Câu 4 (4,5 đi m)ể
1. Hoan thanh cac ph ng trinh phan ng theo s đô sau: ươ ư ơ
CH4A→ A1 A2 Phenol
0
2
t/Ni/H
A3
0
t/CuO
A4
H/KMnO
4
A5 T nilon 6,6ơ
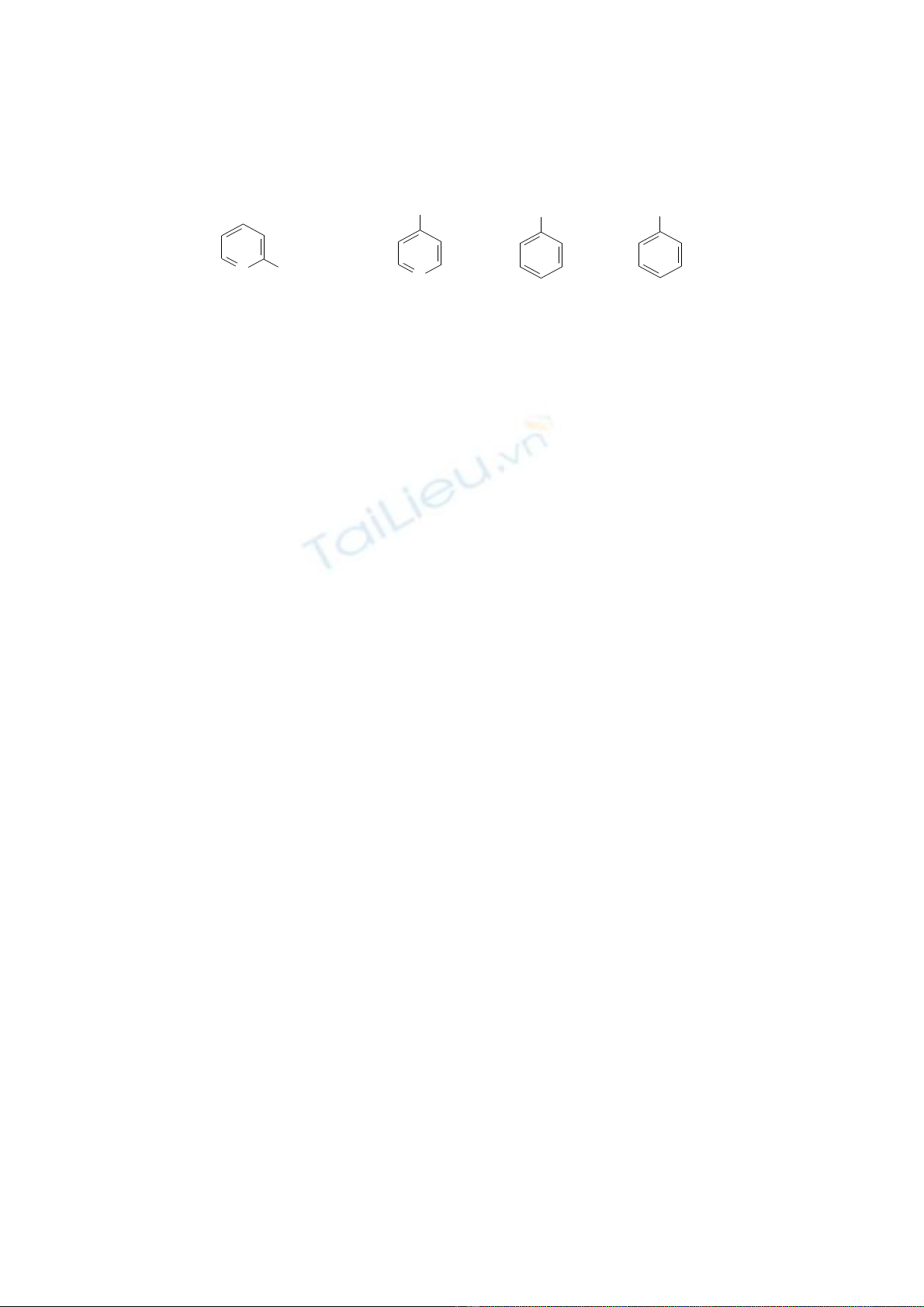
2. Săp xêp (co giai thich) theo trinh t tăng dân nhiêt đô sôi cua cac chât sau đây: ư
a) (CH3)4C b) CH3(CH2)2CH3 c) (CH3)2CHCH(CH3)2 d) CH3(CH2)3CH2OH
(A) (B) (C) (D)
e)(CH3)2C(OH)CH2CH3.(E).
1
Đ CHÍNH TH CỀ Ứ