PHÒNG GIÁO D C & ĐÀO T O Ụ Ạ
NH XUÂNƯ
Đ THI CHON H C SINH GI I C P HUY N Ề Ọ Ỏ Ấ Ệ
NĂM H C 2011 - 2012Ọ
Môn: Hóa H c – L p 9ọ ớ
Th i gian làm bài: ờ150 phút (không k th i gian giaoể ờ
đ)ề
Th i gian thi: Ngày 04 tháng 02 năm 2012ờ
Câu 1.(5,0 đi m).ể
1. Vi t các ph ng trình hóa h c c a các ph n ng có th x y ra khi:ế ươ ọ ủ ả ứ ể ả
a) Cho m u kim lo i Na vào ẫ ạ c c đng ố ự dung d ch Alị2(SO4)3 .
b) D n khí SOẫ2 đi qua c c đng ố ự dung d ch n c Brị ướ 2 .
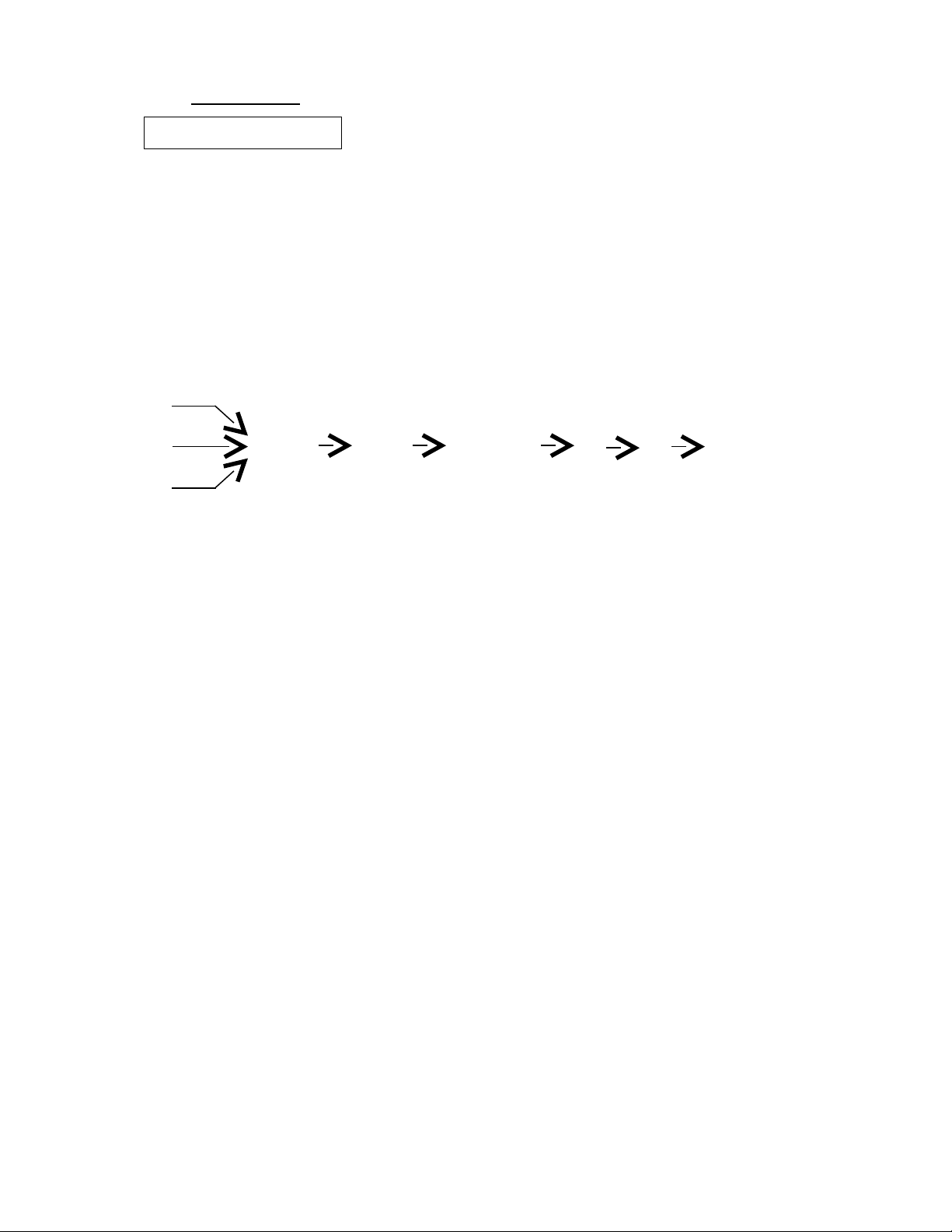
2. Ch n các ch t A, B, C, D thích h p đ hoàn thành các ph ng trình hóa h c theo sọ ấ ợ ể ươ ọ ơ
đ chuy n hóa sauồ ể (m i mũi tên t ng ng v i 1 ph ng trình hóa h c).ỗ ươ ứ ớ ươ ọ
A
B CuSO4 CuCl2 Cu(NO3)2 A B C
C
3. X, Y, Z là các h p ch t c a Na; ợ ấ ủ X tác d ng v i dung d ch ụ ớ ị Y t o thành ạZ. Khi cho Z
tác d ng v i dung d ch HCl th y bay ra khí cacbonic. ụ ớ ị ấ Đun nóng Y cũng thu đc khíượ
cacbonic và Z. H i ỏX, Y, Z là nh ng ch t gì? Cho ữ ấ X, Y, Z l n l t tác d ng v i dung d chầ ượ ụ ớ ị
CaCl2 . Vi t các ph ng trình hóa h c c a các ph n ng x y ra.ế ươ ọ ủ ả ứ ả
Câu 2.(6,0 đi m).ể
1. Ch t các ch t: KMnOỉ ừ ấ 4, BaCl2, H2SO4 và Fe có th đi u ch đc các khí gì? Vi tể ề ế ượ ế
ph ng trình hóa h c c a các ph n ng t o thành các khí đó.ươ ọ ủ ả ứ ạ
2. Có 5 l không nhãn đng 5 dung d ch riêng bi t không màu sau: HCl, NaOH, Naọ ự ị ệ 2CO3,
BaCl2 và NaCl. Ch đc dùng thêm qu tím hãy nh n bi t các l đng các dung d chỉ ượ ỳ ậ ế ọ ự ị
không màu trên.
3. Cho 16,8 lít CO2 ( ởđktc) h p th hoàn toàn vào 600ml dung d ch NaOH 2M thu đcấ ụ ị ượ
dung d ch A. Tính kh i l ng các mu i có trong dung d ch A.ị ố ượ ố ị
Câu 3.(5,0 đi m).ể
Cho 0,51 gam h n h p A d ng b t g m Fe và Mg vào 100 ml dung d ch CuSOỗ ợ ở ạ ộ ồ ị 4. Sau
khi các ph n ng hoàn toàn, l c, thu đc 0,69 gam ch t r n B và dung d ch C. Thêmả ứ ọ ượ ấ ắ ị
dung d ch NaOH d vào C, l y k t t a đem nung ngoài không khí đn kh i l ng khôngị ư ấ ế ủ ế ố ượ
đi, đc 0,45 gam ch t r n D. ổ ượ ấ ắ
a) Tính n ng đ mol c a dung d ch CuSOồ ộ ủ ị 4 đã dùng.
b) Tính thành ph n ph n trăm theo kh i l ng c a m i kim lo i trong h n h p A.ầ ầ ố ượ ủ ỗ ạ ỗ ợ
c) Hòa tan hoàn toàn ch t r n B trong dung d ch Hấ ắ ị 2SO4 đc, nóng thu đc V lít khíặ ượ
SO2 duy nh t đktc. Tính Vấ ở ?
Câu 4.(4,0 đi m).ể
1. Cho 5,2 gam kim lo i M tác d ng v i axit Hạ ụ ớ 2SO4 loãng d thu đc 1,792 lít khí Hư ượ 2 (ở
đktc). Xác đnh kim lo i M.ị ạ
+D
+D
+D
Đ CHÍNH TH CỀ Ứ