
1
BÁO CÁO TỐT NGHIỆP
Vật liệu mao quản trung bình (MQTB) trật tự

2
Chương 1. TỔNG QUAN
1.1. Vật liệu mao quản trung bình (MQTB) trật tự
1.1.1. Giới thiệu chung
- Hai vật liệu tiền thân của các vật liệu MQTB:
+ Aluminophosphat: Như đã biết, zeolit có mao quản rộng nhất là X và Y
(với dạng cấu trúc faujasite) ứng với vòng oxi cực đại là R-12(O). Do đó người ta
phải tìm cách tổng hợp zeolit dạng aluminophosphat (Al-P). Năm 1988 lần đầu tiên
vật liệu có tên gọi VPI-5 với vòng oxi đạt đến 18, R-18(O), đường kính mao quản
12 Å đã được tổng hợp [28], sau đó vào năm 1992 AlPO4 dạng JDF-20 được tổng
hợp với vòng 20 oxi, R-20 (O) [45]. Tuy nhiên, do tính bền nhiệt và thủy nhiệt
không cao nên cho đến nay các vật liệu Al-P vẫn chưa được ứng dụng rộng rãi trong
công nghiệp.
+ Sét pillar: Đây là vật liệu sét tự nhiên có cấu trúc tinh thể dạng lớp.
Khoảng cách giữa các lớp là 9- 10 Å, song do tính biến dạng của sét cao nên người
ta có thể chèn giữa các lớp (bằng kĩ thuật trao đổi ion) các kim loại vừa có tính chất
xúc tác, vừa bền và có kích thước đủ lớn để nới rộng khoảng cách giữa các lớp. Ví
dụ như, từ sét bentonit, người ta chế tạo các Me-pillar dạng Me-montmorillonit với
khoảng cách giữa các lớp 15-20 Å, (Me: Al, Zr, Ca, Cr, Ti, Fe,..). Vật liệu này có
thời điểm là hi vọng của nhiều nhà xúc tác song do độ bền nhiệt và hoạt tính xúc tác
vẫn thấp so với zeolit và đặc biệt không dễ dàng tạo ra vật liệu nano mao quản đồng
nhất như mong đợi nên sét pillar vẫn chưa trở thành các vật liệu xúc tác thương mại
quan trọng.
- Đặc điểm quan trọng nhất của các vật liệu MQTB trật tự (ordered
mesoporous materials) là chúng có mao quản đồng nhất, kích thước mao quản rộng,
diện tích bề mặt riêng lớn, do đó vật liệu sẽ chứa nhiều tâm hoạt động ở trên bề mặt
nên dễ dàng tiếp cận với tác nhân phản ứng. Tuy nhiên, vật liệu MQTB không phải
là vật liệu tinh thể. Xét về mối quan hệ xa thì các mặt mạng, sự sắp xếp các mao

3
quản,… được phân bố theo quy luật tuần hoàn như trong mạng tinh thể, nhưng nhìn
ở góc độ gần thì các phần tử (ion, nguyên tử, nhóm nguyên tử,…) lại liên kết với
nhau một cách vô định hình. Như vậy có thể xem vật liệu MQTB là “giả tinh thể”.
- Một câu hỏi đặt ra là tại sao các vật liệu MQTB được tổng hợp không ở
dạng tinh thể? Các nhà khoa học cho rằng độ tinh thể của vật liệu luôn luôn có mối
quan hệ với mật độ mạng (số nguyên tử trong một nm3: Framework Density, FD).
Năm 1989, Brunner và Meier nhận thấy rằng các cấu trúc tinh thể chứa nguyên tử T
(nguyên tử trong cấu trúc tứ diện-tetragonal) đều phải tuân theo một quy tắc nghiêm
ngặt giữa FD và kích thước vòng T (vòng O) cực tiểu (MINR: Minimum ring) [7].
Thực vậy, các oxit tinh thể với cấu trúc MINR= 4 và ứng với khoảng trống cực đại
trong vật liệu (void fraction)~ 0.5. Các vật liệu MQTB vi phạm quy luật đó nghĩa là
khoảng trống > 0.5 và FD nhỏ nên vật liệu MQTB trật tự không thể là vật liệu tinh thể.
Muốn trở thành vật liệu tinh thể người ta tìm cách gia tăng FD của mạng và làm giảm
bớt độ rỗng nghĩa là mạng của nó phải được cấu tạo đặc hơn, có khả năng tạo ra các
đơn vị cấu trúc thứ cấp SBU (Secondary Building Unit) dạng vòng 3(T) hoặc 3(O).
1.1.2. Giới thiệu một số vật liệu mao quản trung bình trật tự
- Vật liệu với cấu trúc lục lăng (MCM-41)
Năm 1992, các nhà nghiên cứu của công ty dầu mỏ Mobil lần đầu tiên
đã sử dụng chất tạo cấu trúc tinh thể lỏng để tổng hợp một họ rây phân tử mới
MQTB. MCM-41 là một trong những loại vật liệu được nghiên cứu nhiều nhất.
Chúng là vật liệu mao quản hình trụ có đường kính từ 1.5 - 8 nm. Nhóm không gian
của MCM-41 là P6mm (hình 1.1a), thành mao quản là vô định hình và tương đối
mỏng (0.6-1.2 nm). Sự phân bố kích thước lỗ là rất hẹp chỉ ra sự trật tự cao của cấu
trúc. Do mao quản chỉ bao gồm MQTB mà không có vi mao quản bên trong thành
nên dẫn đến sự khuếch tán một chiều qua kênh mao quản. Chúng có diện tích bề
mặt riêng lớn đến khoảng 1000-1200 m2/g. Hạn chế quan trọng nhất của vật liệu
này là độ bền thủy nhiệt chưa cao do thành khá mỏng và vô định hình [61].
4
Vật liệu với cấu trúc lập phương
+ KIT-5: là silica MQTB với tính chất tương tự như SBA-16. MQTB
là trật tự với dạng cấu trúc lập phương tâm mặt Fm3m. Giống như SBA-16, KIT-5
có thể được tổng hợp trong hệ bậc 3 gồm nước, butanol và chất hoạt động bề mặt
F127. Khác với SBA-16, trong trường hợp này mỗi MQTB trong KIT-5 chỉ được
liên kết thống kê với một MQTB khác và sắp xếp theo kiểu cấu trúc tâm mặt.
+ MCM-48 và KIT-6: là 2 vật liệu đều có cấu trúc 3-D thuộc nhóm
không gian Ia3d. Đặc trưng nhất về cấu trúc của loại vật liệu này là kiến trúc theo
kiểu vòng xoáy (hình 1.2). MCM-48 được tổng hợp theo cách tương tự như MCM-
41 dưới điều kiện kiềm với chất hoạt động bề mặt genimi. Độ dày thành mao quản
của MCM-48 là khoảng 0.8-1 nm. Kích thước mao quản cũng tương tự như MCM-
41. KIT-6 có thể được tổng hợp sử dụng pha meso bậc 3 là H2O, BuOH và P123.
Độ dày thành mao quản và chiều mao quản tương tự như SBA-15 [56].
1.1.3. Vật liệu họ SBA ( Santa Barbara)
a. Khái quát
Năm 1998, Zhao và các cộng sự [92] đã tổng hợp được họ vật liệu mới, kí
hiệu là SBA-n, có cấu trúc lục lăng 2-D và 3-D (SBA-2, 3, 12, 15) hoặc lập phương
(SBA-1, 6, 16), trong đó nổi bật nhất là SBA-15 và SBA-16.
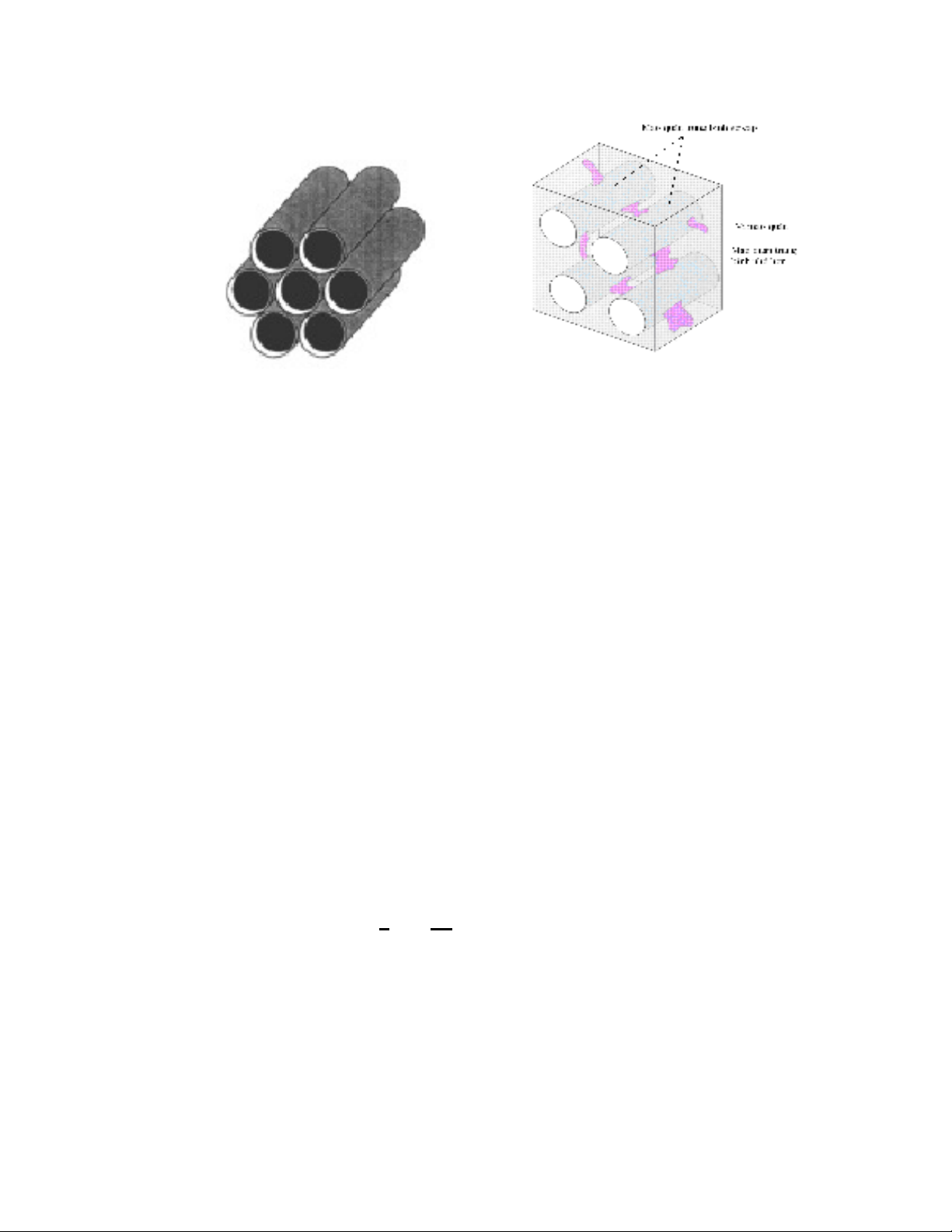
Hình 1.1a
:
Mô hình
mao quản
sắp xếp theo dạng lục lăng
Hình 1.1b
:
Sự kết nối các kênh mao quản
sơ cấp qua mao quản thứ cấp của SBA-15

5
Hai vật liệu này được tổng hợp khi sử dụng chất tạo cấu trúc (template) hay
tác nhân định hướng cấu trúc ( SDA: struture-directing agent) là các chất hoạt động
bề mặt copolime 3 khối Pluronic (P123: m = 20, n=70; F127: m=106, n=70):
SBA-15 là vật liệu MQTB ở dạng lục lăng (hình 1.1a) cùng nhóm không
gian P6mm với MCM-41 nhưng được tổng hợp trong môi trường axit (khác với
MCM-41 trong môi trường kiềm) và sử dụng chất hoạt động bề mặt không ion.
Tuy nhiên, do tính chất của chất hoạt động bề mặt loại Pluronic, vật liệu
SBA-15 so với vật liệu MCM-41 có sự khác nhau quan trọng về mao quản và tính
chất hấp phụ. Trong cách tổng hợp thông thường, SBA-15 có thành mao quản dày
hơn nhưng vẫn là vô định hình. Diện tích bề mặt BET của SBA-15 thường thấp hơn
MCM-41 và do thành mao quản dầy nên chúng có độ bền thủy nhiệt lớn hơn. Cũng
do loại chất hoạt động bề mặt Pluronic, SBA-15 có mao quản thứ cấp bên trong
thành, bao gồm vi mao quản và mao quản trung bình nhỏ hơn. Kênh mao quản
chính song song của SBA-15 được kết nối với nhau qua các vi lỗ và mao quản trung
bình nhỏ hơn trong thành mao quản [25] (hình 1.1b).
SBA-16 là silica MQTB với kích thước mao quản 5-15 nm dạng lồng sắp
xếp trong dạng lập phương tâm khối 3 chiều thuộc nhóm không gian Im3m. Giống
Hình 1.2: Mô hình cấu
trúc vòng xoáy của KIT-6
Hình 1.3 : Sự kết nối kênh MQ sơ cấp qua
8 kênh MQTB nhỏ hơn của SBA-16


























