
TRƯỜNG THPT ĐÀO SƠN TÂY
TỔ HÓA HỌC
Học sinh:
…………………………………………………………………………………………….
Lớp:
……………..
Tài liệu lưu hành nội bộ
Tháng 9/2021


MỤC LỤC
PHẦN A. LÝ THUYẾT ........................................................................................................................ 1
ÔN TẬP ĐẦU NĂM ............................................................................................................................. 1
BÀI 1: SỰ ĐIỆN LI ............................................................................................................................... 2
BÀI 2: AXIT – BAZƠ – MUỐI ............................................................................................................ 3
BÀI 3: SỰ ĐIỆN LI CỦA NƯỚC. pH. CHẤT CHỈ THỊ AXIT-BAZƠ ............................................... 4
BÀI 4: PHẢN ỨNG TRAO ĐỔI ION TRONG DUNG DỊCH CÁC CHẤT ĐIỆN LI ........................ 6
BÀI 5: LUYỆN TẬP AXIT, BAZƠ VÀ MUÔI. PHẢN ỨNG TRAO ĐỔI ION TRONG DUNG
DỊCH CÁC CHẤT ĐIỆN LI ................................................................................................................. 8
BÀI 7: NITƠ .......................................................................................................................................... 9
BÀI 8: AMONIAC VÀ MUỐI AMONI ............................................................................................. 10
BÀI 9: AXIT NITRIC VÀ MUỐI NITRAT........................................................................................ 12
BÀI 10: PHOTPHO ............................................................................................................................. 15
BÀI 11: AXIT PHOTPHORIC VÀ MUỐI PHOTPHAT.................................................................... 16
BÀI 12: PHÂN BÓN HÓA HỌC ........................................................................................................ 17
BÀI 13: LUYỆN TẬP TÍNH CHẤT CỦA NITƠ, PHOTPHO VÀ CÁC HỢP CHẤT ...................... 19
BÀI 14: THỰC HÀNH TÍNH CHẤT CỦA MỘT SỐ HỢP CHẤT NITƠ, PHOTPHO .................... 19
BÀI 15: CACBON ............................................................................................................................... 20
BÀI 16: HỢP CHẤT CỦA CACBON................................................................................................. 21
BÀI 17: SILIC VÀ HỢP CHẤT CỦA SILIC ..................................................................................... 24
BÀI 18: CÔNG NGHIỆP SILICAT .................................................................................................... 26
BÀI 19: LUYỆN TẬP TÍNH CHẤT CỦA CACBON, SILIC VÀ HỢP CHẤT CỦA CHÚNG........ 26
BÀI 20: MỞ ĐẦU VỀ HÓA HỌC HỮU CƠ...................................................................................... 27
BÀI 21: CÔNG THỨC PHÂN TỬ HỢP CHẤT HỮU CƠ ................................................................ 29
BÀI 22: CẤU TRÚC PHÂN TỬ HỢP CHẤT HỮU CƠ .................................................................... 31
PHẦN B. BÀI TẬP.............................................................................................................................. 33
CHƯƠNG 1. SỰ ĐIỆN LI ................................................................................................................... 33
CHƯƠNG 2. NITƠ – PHOTPHO ....................................................................................................... 42
2.1. NITƠ ......................................................................................................................................... 42
2.2. PHOTPHO ................................................................................................................................ 46
CHƯƠNG 3. CACBON – SILIC......................................................................................................... 49
LUYỆN TẬP ....................................................................................................................................... 52
CHƯƠNG 4. ĐẠI CƯƠNG VỀ HỢP CHẤT HỮU CƠ ..................................................................... 55
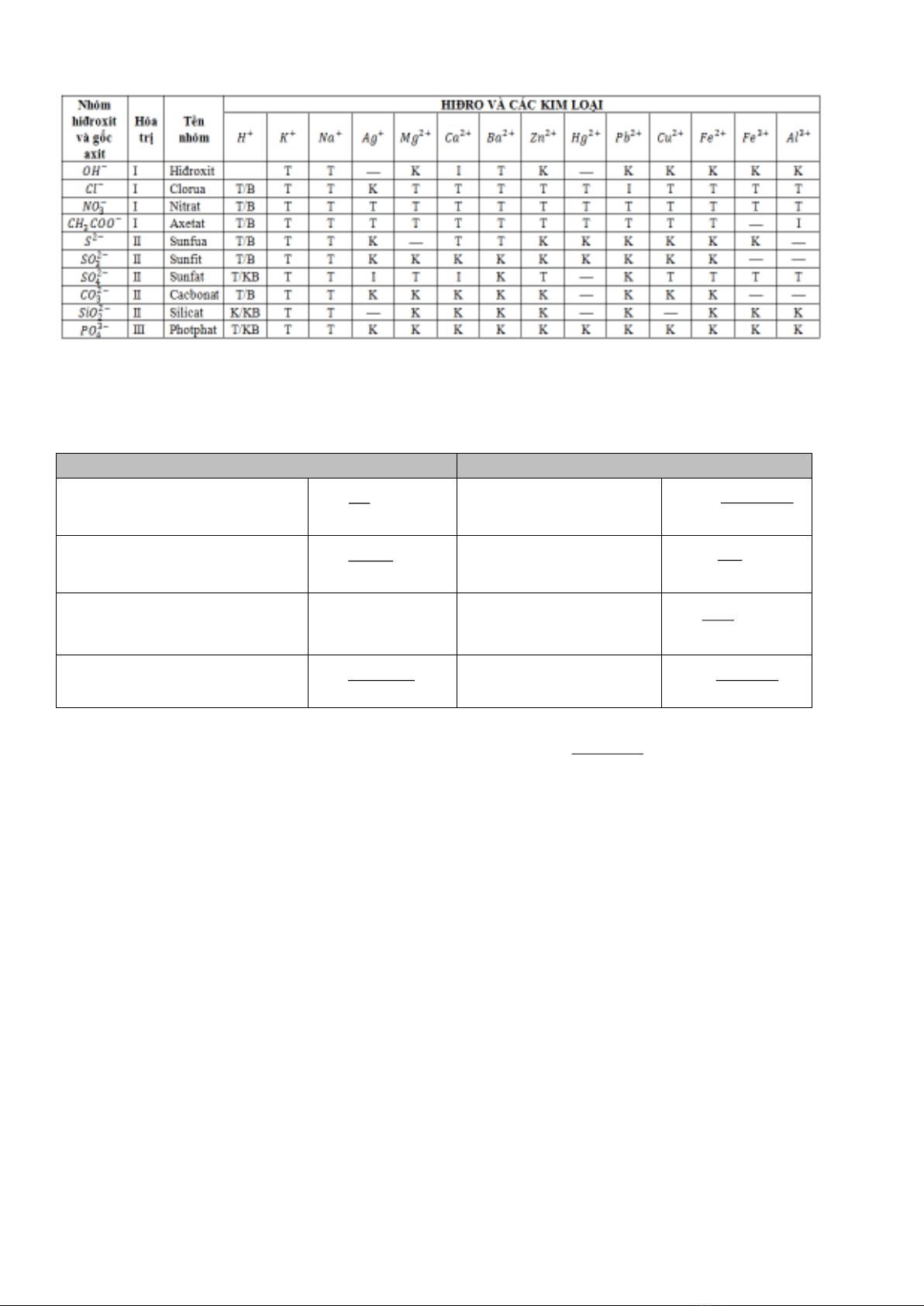
BẢNG TÍNH TAN
MỘT SỐ CÔNG THỨC TÍNH
Công thc tính số mol
Công thc nồng độ dd
có khối lượng (gam) chất
m
nM
Nồng độ phần trăm
dd
.100%
%ct
m
Cm
số mol chất khí ở đkc (0oC và
1 atm)
()
22,4
V lit
n
Nồng độ mol/lit
dd
M
n
CV
V dung dch và CM
n=CM.V
Khối lượng riêng
()
()
g
ml
m
dV
m dung dch và C%
dd
%.
100%.
Cm
nM
Mối liên hệ giữa C% và
CM
%.10d
M
C
CM
Thành phần % theo khối lượng của chất A trong hỗn hợp:
.100%
%A
A
hh
m
mm
Khối lượng nguyên tử (theo đvC) của các nguyên tố:
H = 1; He = 4; Li = 7; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5;
K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; As = 75; Br = 80; Rb = 85; Sr = 88; Ag = 108; Sn = 119;
Ba = 137; Pb = 106

Hóa học 11 - XH
1
PHẦN A. LÝ THUYẾT
ÔN TẬP ĐẦU NĂM
1. Hóa trị các nguyên tố kim loại
I : K, Na, Ag
II : Ba, Ca, Mg, Zn, Fe, Ni, Sn, Pb, Cu, Hg
III : Al, Fe
2. Hóa trị các gốc
Gốc
Tên gọi
Hóa trị
Gốc
Tên gọi
Hóa trị
-OH
Hidroxit
I
SO42-
Sunfat
II
CO32-
cacbonat
II
Cl-
Clorua
I
SO32-
Sunfit
II
NO3-
Nitrat
I
S2-
sunfua
II
PO43-
Photphat
III
2. Công thức tính nồng độ
Nồng độ phần trăm:
dd
.100%
%ct
m
Cm
; Nồng độ mol/lit:
dd
M
n
CV
Khối lượng riêng:
()
()
g
ml
m
dV
; Mối liên hệ giữa C% và CM:
%.10d
M
C
CM
3. Lí luận lượng dư
Dấu hiệu: đề bài cho hai số mol của chất tham gia.
Lập tỉ lệ: số mol/hệ số. Tỉ lệ nhỏ hơn => chất thiếu. Lấy số mol chất thiếu thay vào phương trình
4. Cân bằng phản ứng oxi hóa khử
Cc bước tin hnh
Thc hnh
Bước 1: XĐ số oxi hóa, chất khử, chất
oxi hóa
P + H2SO4 đc, nng H3PO4 + SO2 + H2O
NH3 + CuO
0
t
N2 + Cu + H2O
Bước 2: viết quá trình khử, quá trình
oxi hóa
Bước 3: tìm hệ số cân bằng theo
nguyên tắc (chéo hệ số, rút gọn)
Bước 4: đưa hệ số vào phương trình
theo thứ tự KL-PK-H-O
5. Tính chất axit HCl, H2SO4
HCl, H2SO4 loãng: tính axit mạnh
Làm quỳ tím ha đỏ


























