Chương 2 nvhoa102@gmail.com 1
CHƯƠNG 2: LIÊN KẾT HÓA HỌC VÀ CẤU TẠO PHÂN TỬ
NỘI DUNG
1. Đại cương về liên kết hóa học
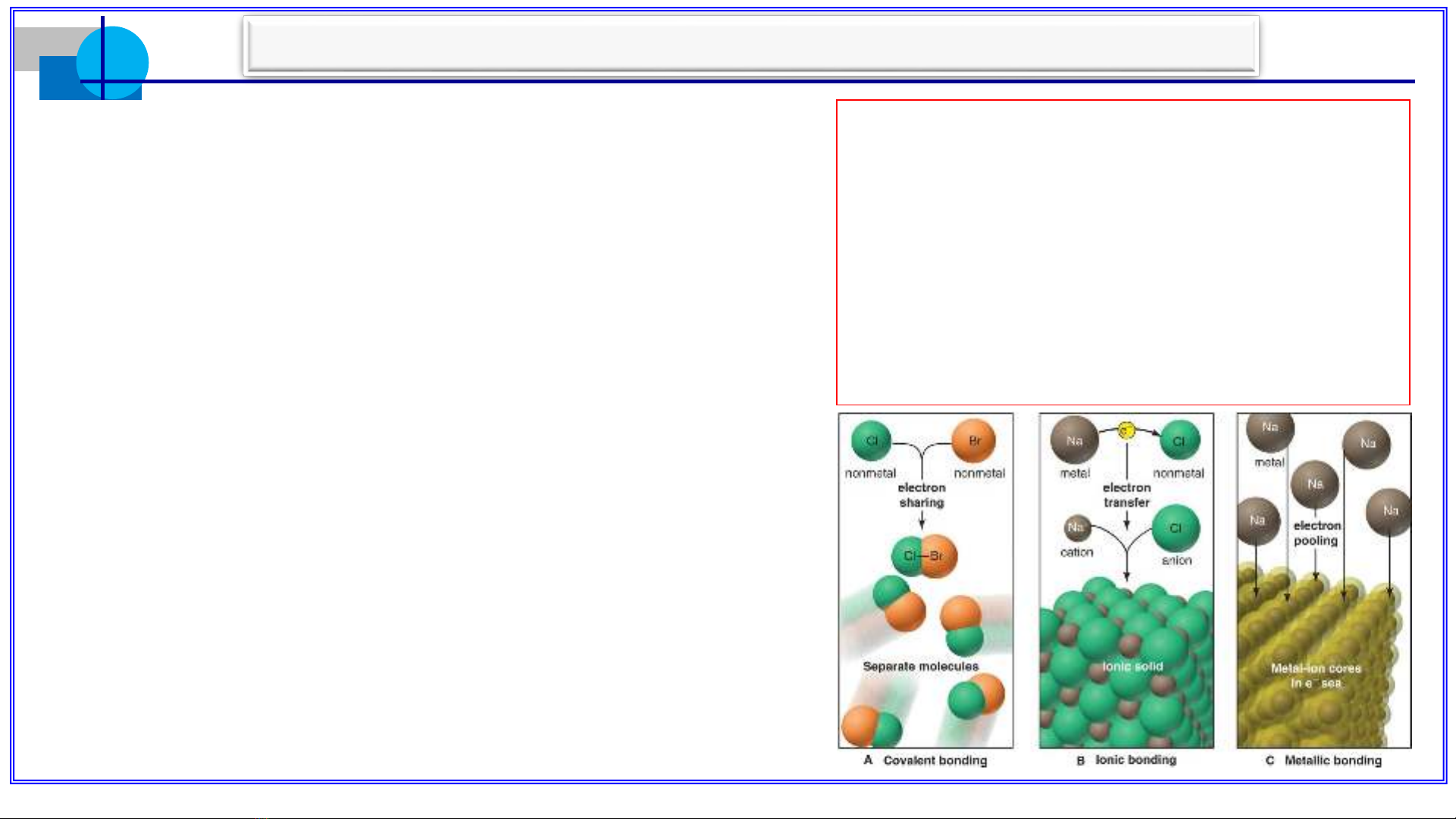
2. Liên kết cộng hóa trị
2.1. Phương pháp liên kết hóa trị
(phương pháp VB)
2.2. Phương pháp orbital phân tử
(phương pháp MO)
3. Liên kết ion
4. Liên kết kim loại
5. Liên kết hydrogen
6. Lực van der Waals
TÀI LIỆU
[1] – Chương 4: trang 124 –201
[2] –Chapter 9: page 269 –308
Chapter 10: page 309 –348
Chapter 11: page 349 –400