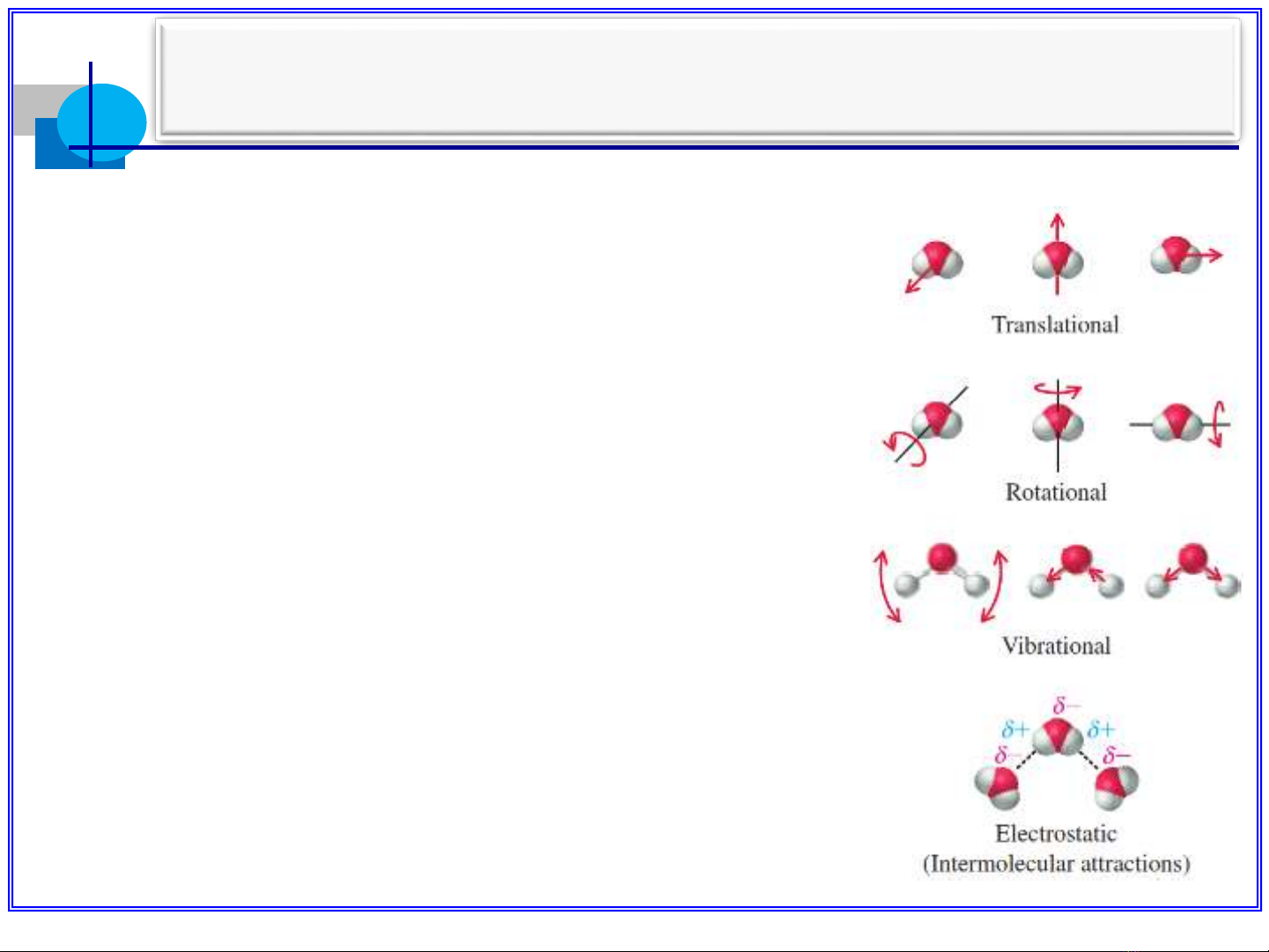
Chương 3 nvhoa102@gmail.com 1
NỘI DUNG
1. Một số khái niệm
2. Nguyên lý I và
hiệu ứng nhiệt
3. Nguyên lý II và
entropy
4. Thế đẳng áp và
chiều xảy ra quá
trình hóa học
5. Cân bằng hóa học
TÀI LIỆU
[1] – Chương 6: trang 226 –78
Chương 7: trang 257 –275
Chương 8: trang 276 –297
[2] –Chapter 6: page 182 –214
Chapter 14: page 486 –519
Chapter 18: page 606 –635
CHƯƠNG 3: NHIỆT ĐỘNG LỰC HỌC CỦA CÁC QUÁ
TRÌNH HÓA HỌC