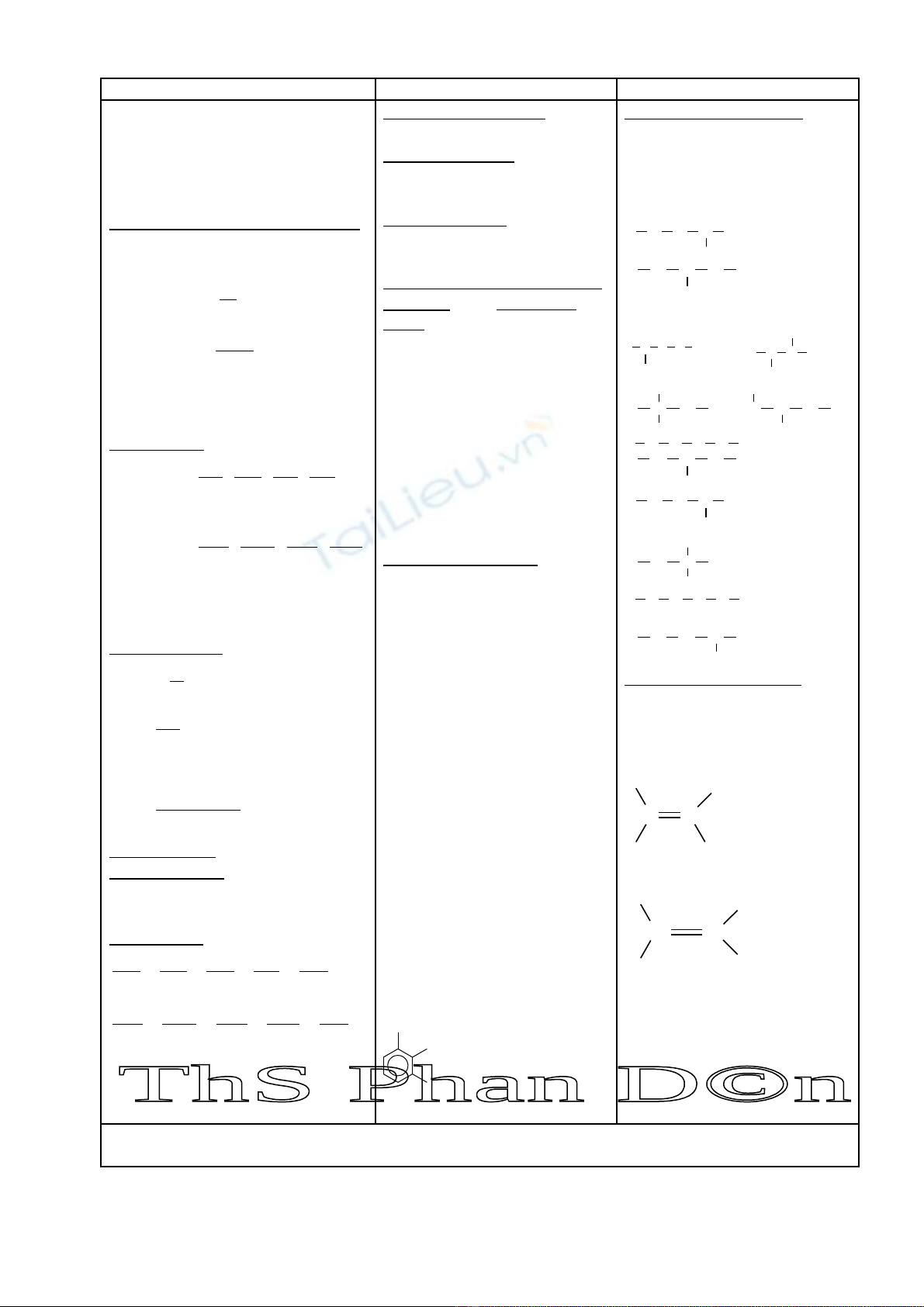
TÓM T T LÝ THUY T CH NG IVẮ Ế ƯƠ : Đ I C NG V HÓA H C H U CẠ ƯƠ Ề Ọ Ữ Ơ
L P CTPTẬDANH PHÁP Đ NG PHÂNỒ
Phân tích đ nh tính (1)ị
Phân tích đ nh l ng (2)ị ượ
⇒ CT Đ N GI N NH TƠ Ả Ấ
Tìm M
⇒CTPT
1. Cách l p CT Đ n gi n nh tậ ơ ả ấ
A: CxHyOzNt
a. Tìm mC, mH, mN, mO
2 2
3
12 11
C CO CO
m n m= =
2
2
29
H O
H H O
m
m n= =
2 2
28
N N N
m n m= =
O A C H N
m m m m m= − − −
b. L p t lậ ỉ ệ:
: : : : : :
12 1 16 14
C O N
H
m m m
m
x y z t =
Ho cặ
% % % %
: : : : : :
12 1 16 14
C H O N
x y z t =
đ a v s nguyên nh nh tư ề ố ỏ ấ
: : :s p r v=
⇒CTĐG I: CsHpOrNv
2. Cách tìm M
MA =
.
B
A
d M
B
MA =
A
A
m
n
MA =
22,4.
A
d
( đktc)ở
MA =
. .1000
.
ct
dm
K m
m t∆
3. Tìm CTPT
a. T CTĐG Iừ
CTPT A: (CsHpOrNv)n
Tìm MA⇒ n ⇒ CTPT
b. Dùng CT
12 16 14
A
C H O N A
Mx y z t
m m m m m
= = = =
12 16 14
% % % % 100
A
Mx y z t
C H O N
= = = =
1.Tên thông th ngườ
Theo ngu n g c tìm ra chúngồ ố
2. Tên g c-ch cố ứ
Tên ph n g c+tên ph nầ ố ầ
ch cứ
3. Tên thay thế
Tên ph n th +Tên m ch Cầ ế ạ
chính + Tên ph n đ nh ch cầ ị ứ
a. S đ m và tên m ch chínhố ế ạ
S đ mố ế Tên m chạ
chính
mono met
đi et
tri pro
tetra but
penta pent
hexa hex
hepta hept
octa oct
nona non
đeca đec
b. Tên m t s g cộ ố ố
hiđrocacbon hóa tr I:ị
CH3- : Metyl ; C2H5- : Etyl
CH3-CH2-CH2- : Propyl
(Prop-1-yl)
(CH3)2CH- : isopropyl (Prop-2-yl)
CH3CH2CH2CH2- : Butyl
(But-1-yl)
CH3CH(CH3)CH2- : isobutyl
(2-metylprop-1-yl)
CH3CH2(CH3)CH- : sec-butyl
(But-2-yl)
(CH3)3C- : tert-butyl
(2-metylpro-2-yl)
CH3CH(CH3)CH2CH2- :
isoamyl (2-metylbut-1-yl)
CH2=CH- : vinyl
CH2=CH-CH2- : anlyl
C6H5- : Phenyl
C6H5-CH2- : Benzyl
o-C6H4-CH3 : o-tolyl
m-C6H4-CH(CH3)2 :m-cumenyl
CH
3
CH
3
2,3-xilyl
1. Đ ng phân c u t oồ ấ ạ :
Cùng CTPT, khác nhau về
c u t o hóa h cấ ạ ọ
Vd: C5H12O có các đ ng phânồ
c u t o:ấ ạ
C-C-C-C-C-OH
CCCCC
OH
CCCCC
OH
C C C
C
C OH
CCCC
C
OH
C C C C
C
OH
C C C C
C
OH
C O C C C C
C O C C C
C
C O C C C
C
C O C C
C
C
C C O C C C
C C O C C
C
2. Đ ng phân l p thồ ậ ể:
Cùng CTCT, nh ng khácư
nhau v c u trúc không gianề ấ
VD:
C C
Cl Cl
HH
cis-đicloeten
CC
Cl
Cl
H
H
trans-đicloeten
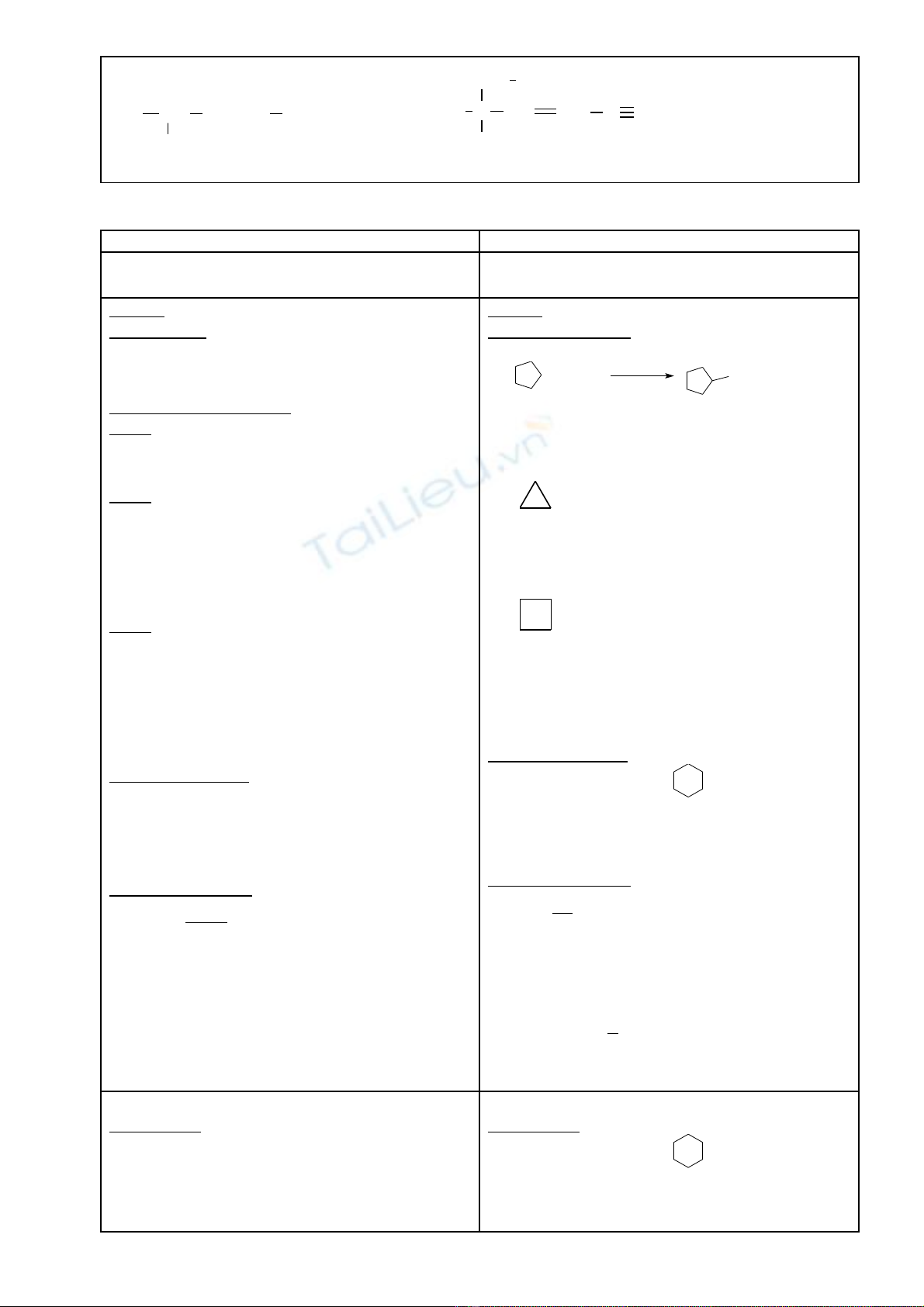
CH3CH CH=CH
OH
CH3
1 2 34 5
Pent-3-en-2-ol.
CH
3
C CH
CH
3
CH
2
CH
3
CH C CH
31
24
5
6 7
5,5-đimetyl hept-3-en-1-in
TÓM T T LÝ THUY T CH NG VẮ Ế ƯƠ : HIĐROCACBON NO
ANKAN (PARAFIN) MONOXICLOANKAN
Công th c chung: ứCnH2n + 2 ( n ≥ 1 )
(h , no)ởCnH2n ( n ≥ 3 )
(đ n vòng no)ơ
TCHH
1. Ph n thả ế v i Brớ2 ho c Clặ2 khi có as ho c tặ0:
CH3-CH2-CH3 + Br2
as
( )HBr−
CH3CHBrCH3
(spc)
C ch ph n ng thơ ế ả ứ ế:
GĐ 1: Kh i màu ph n ng ơ ả ứ
as 0 0
X X X X− +
GĐ 2: Phát tri n dây chuy nể ề
0 0
(1)R H X R HX− + +
0 0
(2)R X X R X X+ − − +
0
...
.......
R H X− +
GĐ 3: Đ t dây chuy n:ứ ề
0 0
2
X X X+
0 0
0 0
R X R X
R R R R
+ −
+ −
2. Ph n ng táchả ứ ( gãy liên k t C-C và C-H )ế
CH3CH2CH2CH3
0
500 ,C xt
CH3CH=CH-CH3 + H2
CH4 + CH3CH=CH2
C2H6 + CH2=CH2
3. Ph n ng cháyả ứ :
CnH2n+2 +
3 1
2
n+
O2
nCO2 + (n + 1) H2O
Nh n xét: ậ
+
2 2
H O CO
n n>
+
2 2
ankan H O CO
n n n= −
TCHH
1. Ph n ng thả ứ ế v i Brớ2 ho c Clặ2 khi có as
ho c tặ0
+
Br
2
Br
+
HBr
Ngoài ra xiclopropan, xiclobutan còn có ph nả
ng c ng m vòngứ ộ ở
-H2, Br2, HBr đ u m đ c vòng xiclopropanề ở ượ
+ H2
0
,80Ni
CH3CH2CH3
+ Br2
BrCH2CH2CH2Br
+ HBr
BrCH2CH2CH3
-H2 m đ c vòng xilobutanở ượ
+ H2
CH3CH2CH2CH3
2. Ph n ng táchả ứ
CH3[CH2]4CH3
0
,t xt
+ H2
3. Ph n ng cháyả ứ :
CnH2n +
3
2
n
O2
nCO2 + nH2O
Nh n xét: ậ
+
2 2
H O CO
n n=
+
2
ox
1
mon icloankan CO
n n
n
=
ĐI U CHỀ Ế:
Al4C3 + 12H2O
3CH4 + 4Al(OH)3
RCOONa + NaOH (r)
CaO
nung
RH + Na2CO3
ĐI U CHỀ Ế:
CH3[CH2]4CH3
0
,t xt
+ H2

CH3[CH2]5CH3
0
,t xt
CH
3
+ H2
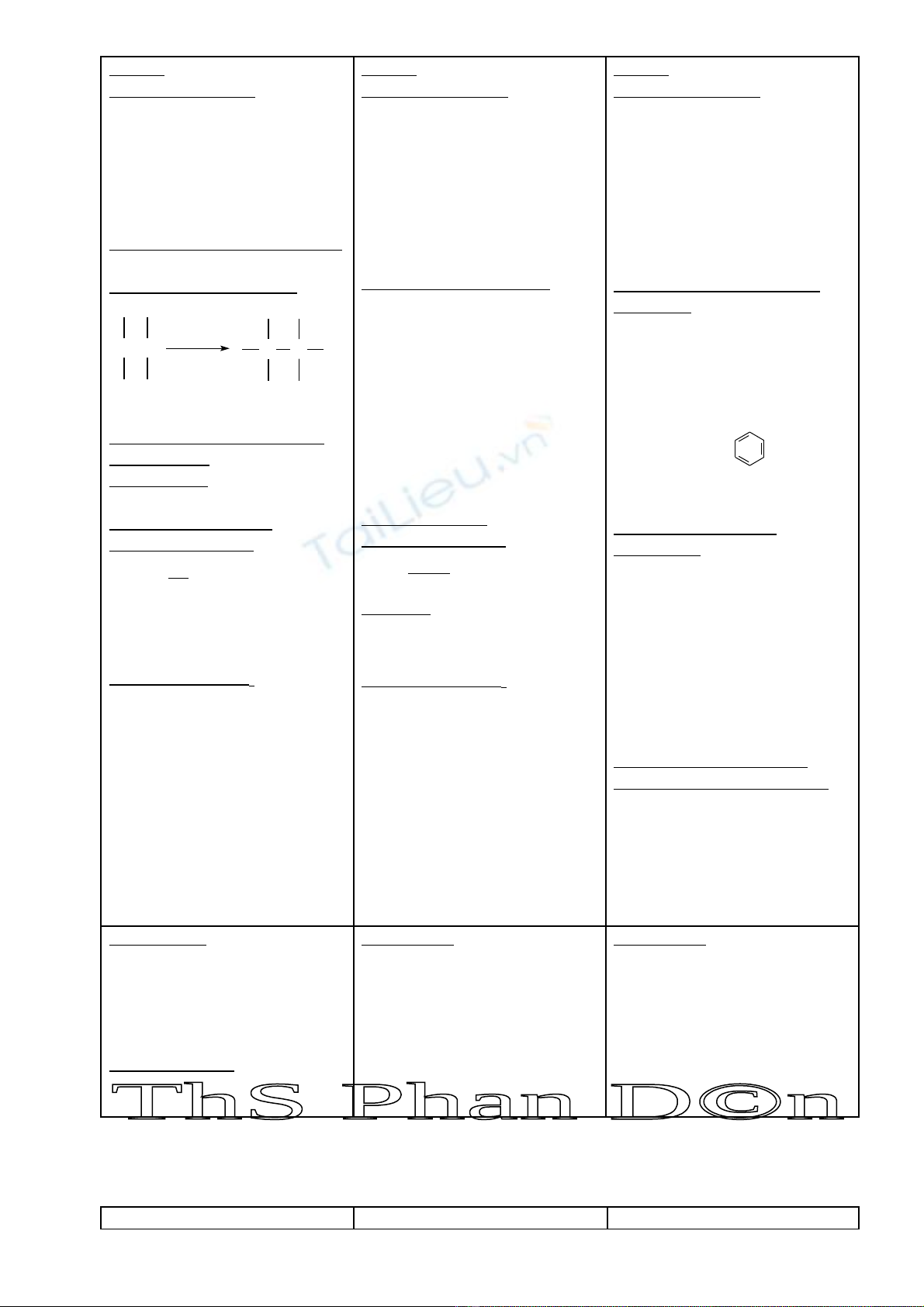
TÓM T T LÝ THUY T CH NG VIẮ Ế ƯƠ : HIĐROCACBON KHÔNG NO
ANKEN (OLEFIN) ANKAĐIEN ANKIN
CT Chung: CnH2n ( n ≥ 2 )
(h , có 1 n i đôi)ở ố CT Chung: CnH2n-2 ( n ≥ 3 )
(h , có 2 n i đôi)ở ố CT Chung: CnH2n-2 ( n ≥ 2 )
(h , có 1 n i ba)ở ố
TCHH
1. Ph n ng c ngả ứ ộ :
C=C
tac nhan cong
C-C
Tác nhân c ng:ộ
V i: + Hớ2 (Ni, t0)
+ Halogen X2/CCl4
+ Axit H-A
+ H-OH (H+, t0)
Quy t c c ng Maccopnhicopắ ộ
2. Ph n ng trùng h pả ứ ợ :
(C C )n
nC=C
Monome Polime
ĐK:
+ Ch t trùng h p ph i cóấ ợ ả
liên k t b i.ế ộ
+ Có t 0
, p, xt .
3. Ph n ng oxi hóaả ứ :
a) Ph n ng cháyả ứ :
CnH2n +
3
2
n
O2
nCO2 + nH2O
b) V i dd KMnOớ4:
3CnH2n + 2KMnO4 + 4H2O
3CnH2n(OH)2 + 2MnO2 + 2KOH
TCHH
1. Ph n ng c ngả ứ ộ :
C=C-C=C
C-C-C=C
C-C=C-C
C-C-C-C
2. Ph n ng trùng h pả ứ ợ :
nC=C-C=C
(-C-C=C-C-)n
Monome Polime
3. Ph n oxi hóaả:
a) Ph n ng cháyả ứ :
CnH2n-2 +
3 1
2
n−
O2
nCO2 + (n-1)H2O
Nh n xétậ:
2 2 2 2n n
C H CO H O
n n n
−
= −
b) V i dd KMnOớ4:
C=C-C=C
4
ddKMnO+
C(OH)C(OH)C(OH)C(OH)
TCHH
1. Ph n ng c ngả ứ ộ :
C≡C
C=C
C-C
2. Ph n ng đime hóa vàả ứ
trime hóa:
2C2H2
4
CuCl
NH Cl
CH2=CH-
C≡CH
Vinyl axetilen
(But-1-en-3-in)
3C2H2
0
600
C
C
benzen
3. Ph n ng oxi hóaả ứ :
a) P cháyư: t ng tươ ự
ankađien.
b) V i dd KMnOớ4:
C≡C
4
1.dd
2.
KMnO
H
+
HOOC-COOH
C-C≡C
4
1.dd
2.
KMnO
H
+
C-COOH + CO2
4. Ph n ng th H Cả ứ ế ở
mang n i ba b ng ion b cố ằ ạ :
CH≡CH + 2[Ag(NH3)2]OH
AgC≡CAg↓ + 4NH3 + 2H2O
T ng t :ươ ự
R-C≡CH
R-C≡CAg↓
(Dùng đ nh n bi t ank-1-in) ể ậ ế
ĐI U CH Ề Ế
CnH2n+1OH
2 4 0
H SO damdac
t
CnH2n + H2O
CnH2n+1X + KOH
0
tane ol
t
CnH2n + KX + H2O
Quy t c Zaixepắ
ĐI U CHỀ Ế
CH3CH2CH2CH3
0
,xt t
CH2=CH-CH=CH2 + 2H2
CH3C(CH3)CH2CH3
0
,xt t
CH2=C(CH3)-CH=CH2 + 2H2
ĐI U CHỀ Ế
CaC2 + 2H2O
C2H2 + Ca(OH)2
CH2X-CH2X + 2KOH
tane ol
CH≡CH + 2KX + 2H2O
2CH4
0
1500 C
lamlanhnhanh
C2H2 + 3H2
TÓM T T LÝ THUY T CH NG VIIẮ Ế ƯƠ : HIĐROCACBON TH MƠ
BENZEN và ANKYLBENZEN STIREN NAPHTALEN
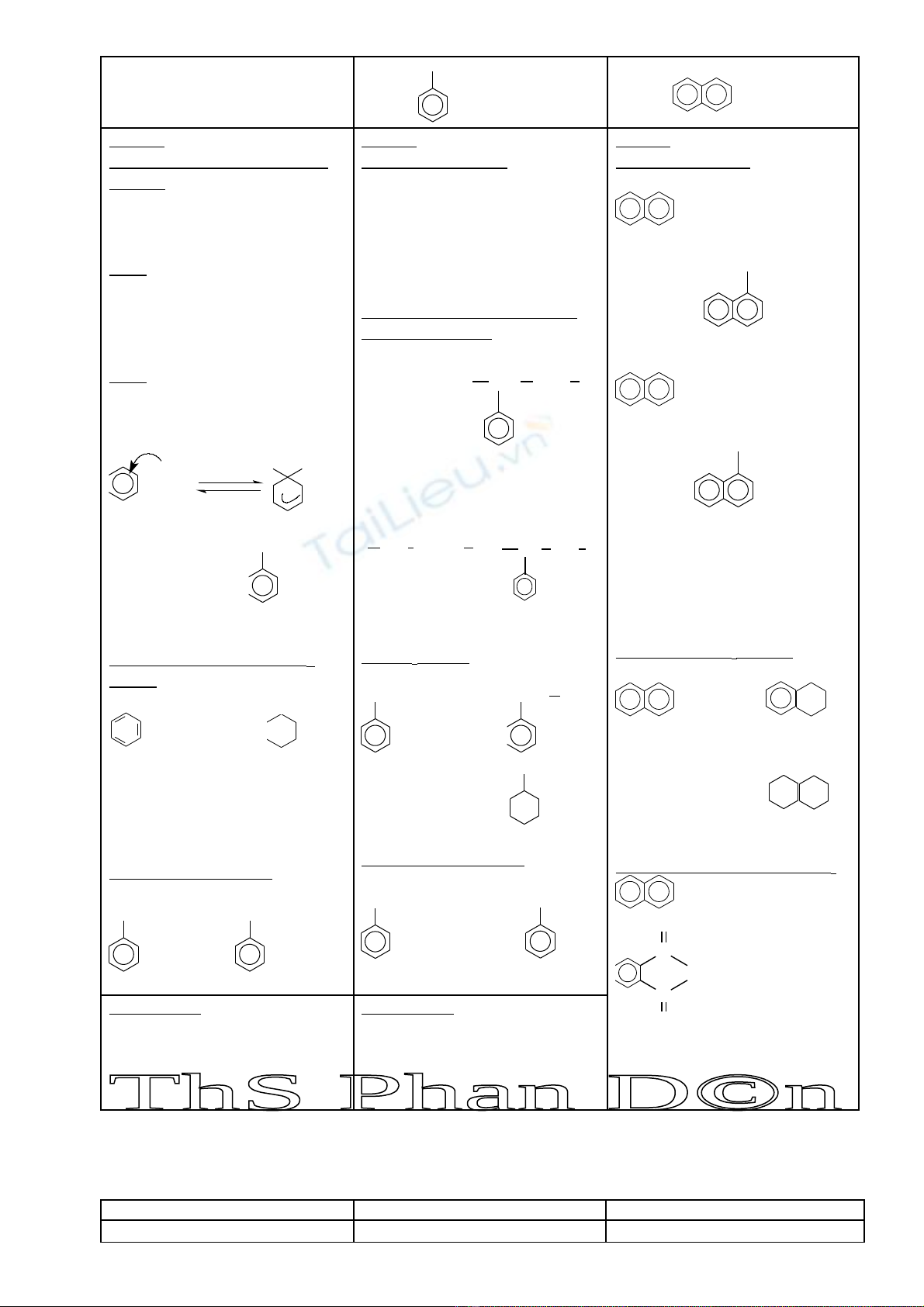
CT Chung: CnH2n-6 ( n ≥ 6 )
CTCT:
CH=CH
2
CTCT:
TCHH
1. Ph n ng th H vòngả ứ ế ở
benzen:
V i : + Brớ2 khan, khí Cl2 (Fe)
+ HONO2 đ (H2SO4đ)
C ch : ơ ế
GĐ1: T o ti u phân mangạ ể
đi n d ngệ ươ
Vd: HO-NO2 + H+
テ
NO2(+)+H2O
Ho c ặ
X2 + Fe
テ
[FeX4]- + Br+
GĐ2: Ti u phân mang đi nể ệ
d ng t n công tr c ti p vàoươ ấ ự ế
vòng benzen
+NO
2
+
+
NO
2
H
↓
NO
2
+
H
+
2. Ph n ng c ng v i Hả ứ ộ ớ 2
(Ni,t 0
)
+ 3H2
0
,Ni t
3. Ph n ng oxi hóaả ứ :
V i dd KMnOớ4/H+
CH
3
4
KMnO
H
+
+
COOH
TCHH
1. Ph n ng c ngả ứ ộ :
C6H5CH=CH2 + Br2
C6H5CHBr-CHBr
C6H5CH=CH2 + HCl
C6H5CHCl-CH3
2. Ph n ng trùng h p vàả ứ ợ
đ ng trùng h pồ ợ :
nC6H5CH=CH2
0
,xt t
(CH CH2)n
Polistiren
nCH2=CH-CH=CH2 +
nC6H5CH=CH2
0
,xt t
CH CH
2
)
n
(CH
2
CH=CH CH
2
poli(butađien-stiren)
V i Hớ2 (Ni,t 0
)
CH=CH
2
2
0
,
H
Ni t
+
CH
2
CH
3
2
0
4
,
H
Ni t
+
CH
2
CH
3
3. Ph n ng oxi hóaả ứ :
CH=CH
2
4
0
,
KMnO
H t
+
+
COOH
TCHH
1. Ph n ng thả ứ ế:
+ Br2
3
CH COOH
Br
+
HBr
α-bromnaphtalen
+ HONO2
2 4
H SO d
NO2
+H2O
α-nitronapphtalen
2. C ng v i Hộ ớ 2 (Ni, t 0
)
2
0
2
,150
H
Ni C
+
tetralin
Tetralin
2
0
3
,200 ,35
H
Ni C atm
+
đecalin
3. Ph n ng oxi hóa b i Oả ứ ở 2
20
2 5
( )
,300 450
O kk
V O C
+
−
O
O
O
C
C
Anhiđrit phtalic
Th y phân anhiđrit phtalic taủ
s đ c axit phtalicẽ ượ
ĐI U CHỀ Ế:
Hexan
0
2
,
4
xt t
H−
Benzen
Heptan
0
2
,
4
xt t
H−
Toluen
ĐI U CHỀ Ế:
Benzen
2 2
CH CH
H
+
=
Toluen
Toluen
0
2
,xt t
H−
Stiren
TÓM T T LÝ THUY T CH NG VIIIẮ Ế ƯƠ : D N XU T HALOGEN-ANCOL-PHENOLẪ Ấ
D N XU T HALOGENẪ Ấ PHENOL ANCOL
CT Chung: R-X; RX2, RX3, … Ch t đ n gi n: Cấ ơ ả 6H5OH R(OH)x


























