1
Chương 3. Các quá trình nhiệt động của môi chất
3.1. CÁC QUÁ TRÌNH NHIỆT ĐỘNG CƠ BẢN CỦA KHÍ LÝ TƯỞNG
VÀ KHÍ THỰC
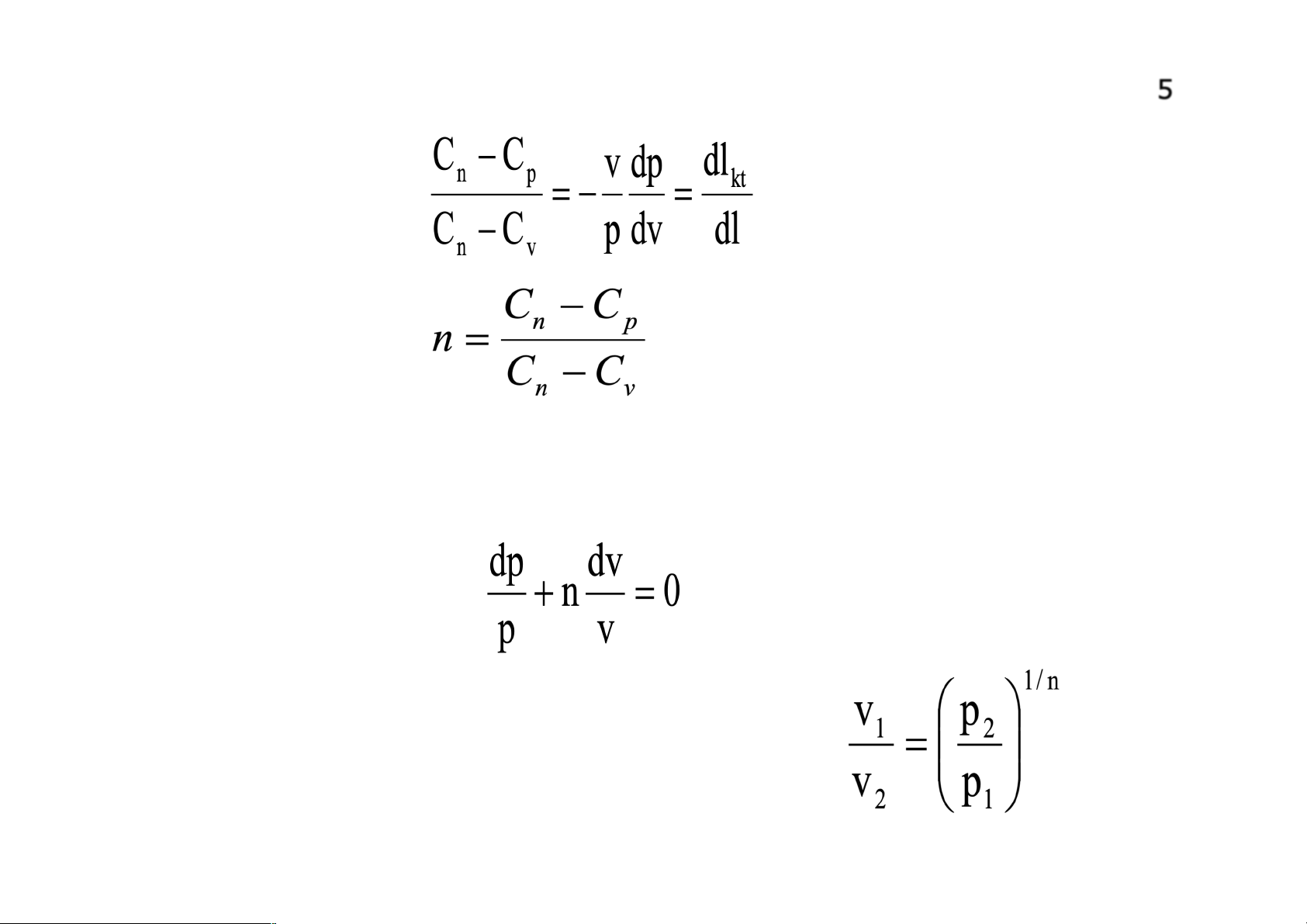
Nghiên cứu quá trình nhiệt động cơ bản nhằm mục đích:
+Tìm mối quan hệ giữa các thông số trạng thái khi quá trình (đa biến,
đẳng áp,đẳng tích…) đã được xác định.
+Tìm quan hệ năng lượng tham gia trong quá trình đó:công thể tích
𝑙12,công kỹ thuật 𝑙kt,nhiệt q, biến thiên nội năng ∆u, ∆i, ∆s.