
KỸ THUẬT NHIỆT
Ngô Quang Nguyên – Trần Nam Dương – Minh Phạm

TỔNG QUAN MÔN HỌC
PHẦN I: NHIỆT ĐỘNG KỸ THUẬT
Chương 1: Khí lý tưởng
Chương 2: Khí thực
Chương 3: Không khí ẩm
Chương 4: Ứng dụng của định luật nhiệt động
Chương 5: Chu trình nhiệt động
PHẦN 2: TRUYỀN NHIỆT
Chương 6: Dẫn nhiệt
Chương 7: Trao đổi nhiệt đối lưu
Chương 8: Trao đối nhiệt bức xạ
Chương 9: Truyền nhiệt và thiết bị trao đổi nhiệt

CHƯƠNG 1: KHÍ LÝ TƯỞNG
1. Các khái niệm cơ bản
2. Phương trình trạng thái
3. Các quá trình nhiệt động cơ bản của khí lý tưởng
4. Hỗn hợp khí lý tưởng
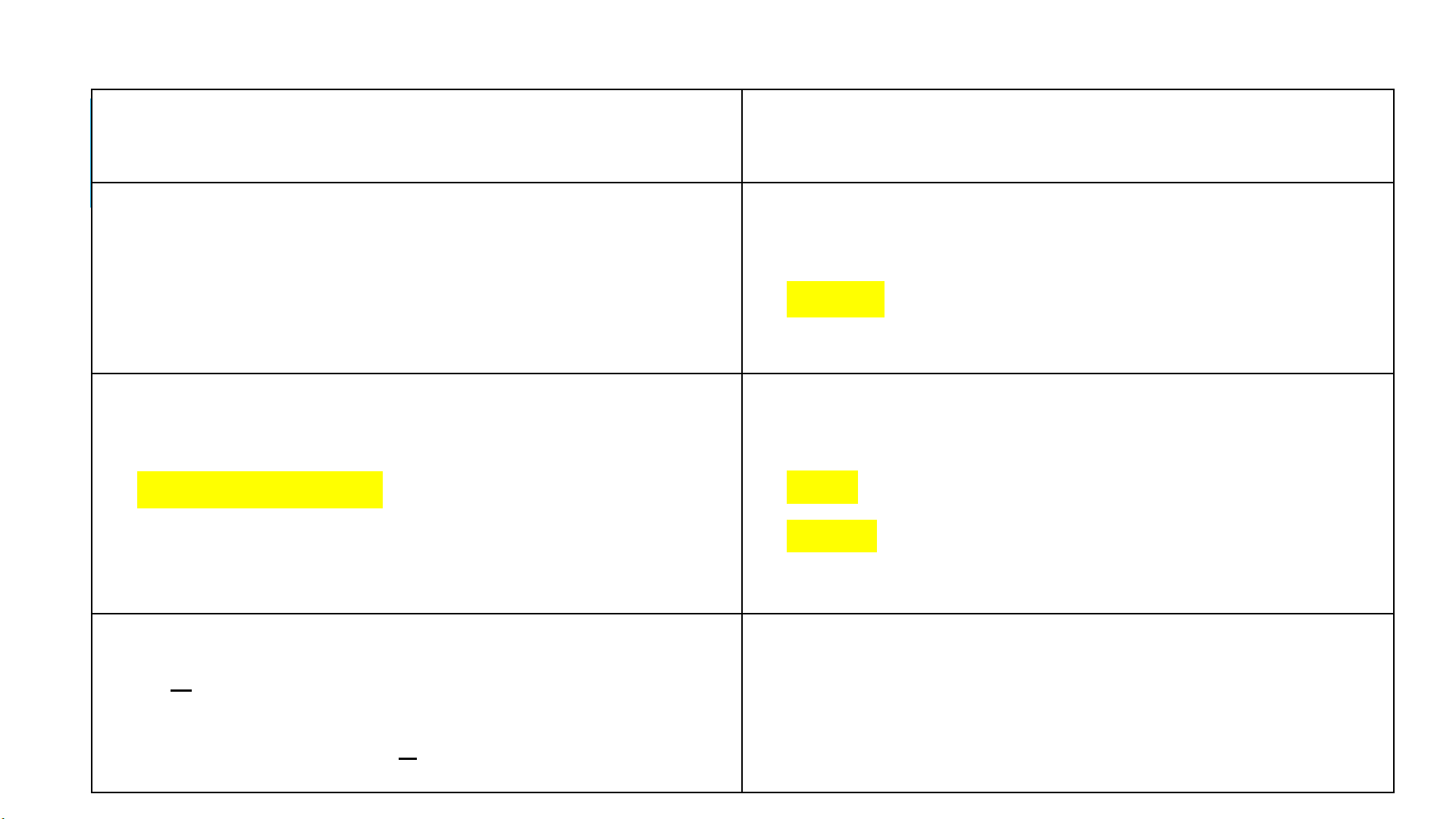
Thông số trạng thái Thông số năng lượng
1, NHIỆT ĐỘ
-
t [oC]; T [oK]
-
T= t+273 [oK]
4, NỘI NĂNG
-
U [kJ]; u [kJ/kg]
-
U=G.u [kJ]
-
Đối với khí lý tưởng: ∆U=G.∆u=G.Cv.(T2-T1)
2, ÁP SUẤT
-
P [N/m2] Pa
-
p=pkq+pdư=pkq-pck
-
1 bar= 105Pa [N/m2]=1,0197 at= 0,987 atm
=750 mmHg=10197 mmH20
5, ENTANPY
-
I [kJ]; i [kJ/kg]
-
I=G.i [kJ]
-
i=u+pv
-
Đối với khí lý tưởng : ∆I=G.∆i=G.Cp.(T2-T1)
3, THỂ TÍCH RIÊNG
-
v=𝑉
𝐺[m3/kg]
-
Khối lượng riêng: ρ=G
V[kg/m3]
6, ENTROPY
-
S [kJ/K]; s [kJ/kgK]
-
S=G.s [kJ/K]
1, Khái niệm cơ bản

CHƯƠNG 1: KHÍ LÝ TƯỞNG
2. Phương trình trạng thái
pv=RT pV=GRT
Trong đó:
+ p-áp suất [Pa] – [N/m2] + G– khối lượng [kg]
+ v-thể tích riêng [m3/kg] + R=8314
ϻ[J/kgK] – hằng số chất khí
+ T– nhiệt độ [oK] + ϻ-khối lượng phân tử
+ V– thể tích [m3]














![Bài tập trắc nghiệm Kỹ thuật nhiệt [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250613/laphong0906/135x160/72191768292573.jpg)
![Bài tập Kỹ thuật nhiệt [Tổng hợp]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250613/laphong0906/135x160/64951768292574.jpg)

![Bài giảng Năng lượng mới và tái tạo cơ sở [Chuẩn SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2024/20240108/elysale10/135x160/16861767857074.jpg)








