S GDỞĐT QU NG BÌNHẢ
Đ CHÍNH TH CỀ Ứ
S BD:……………..ố
KÌ THI CH N H C SINH GI I C P T NH Ọ Ọ Ỏ Ấ Ỉ
NĂM H C 2014 – 2015Ọ
L P 9 - THCSỚ
Môn thi: Hóa h cọ
(Khóa ngày 17 tháng 3 năm 2015)
Th i gian làm bài: 150 phút (không k th i gian giao đ)ờ ể ờ ề
Câu 1. (2,25 đi m)ể
1. Vi t ph ng trình hóa h c c a các ph n ng x y ra (n u có) trong các thí nghi m sau:ế ươ ọ ủ ả ứ ả ế ệ
a. Cho Fe3O4 vào dung d ch Hị2SO4 loãng. b. Đt cháy ancol etylic.ố
c. Cho t t dung d ch HCl đn d vào dung d ch NaAlOừ ừ ị ế ư ị 2. d. S c khí SOụ2 vào dung d ch n c brom.ị ướ
e. Cho kim lo i Ba vào dung d ch CuSOạ ị 4. f. S c khí Hụ2S vào dung d ch Pb(NOị3)2.
g. Cho đm Ure (công th c (NHạ ứ 2)2CO) vào dung d ch Ba(OH)ị2.
2. Cho l ng d kim lo i Na vào ượ ư ạ a gam dung d ch etanol. ịK t thúc ph n ng, th y kh i l ng Hế ả ứ ấ ố ượ 2 sinh ra là
0,04a gam. Vi t ph ng trình hóa h c c a các ph n ng x y ra và tính n ng đ % c a dung d ch etanol. ế ươ ọ ủ ả ứ ả ồ ộ ủ ị
Câu 2. (3,25 đi m)ể
1. Vi t các ph ng trình ph n ng đi u ch polivinylclorua (PVC) và cao su buna t khí axetilen (cho cácế ươ ả ứ ề ế ừ
ch t vô c có đ). Ghi rõ đi u ki n ph n ng (n u có). ấ ơ ủ ề ệ ả ứ ế
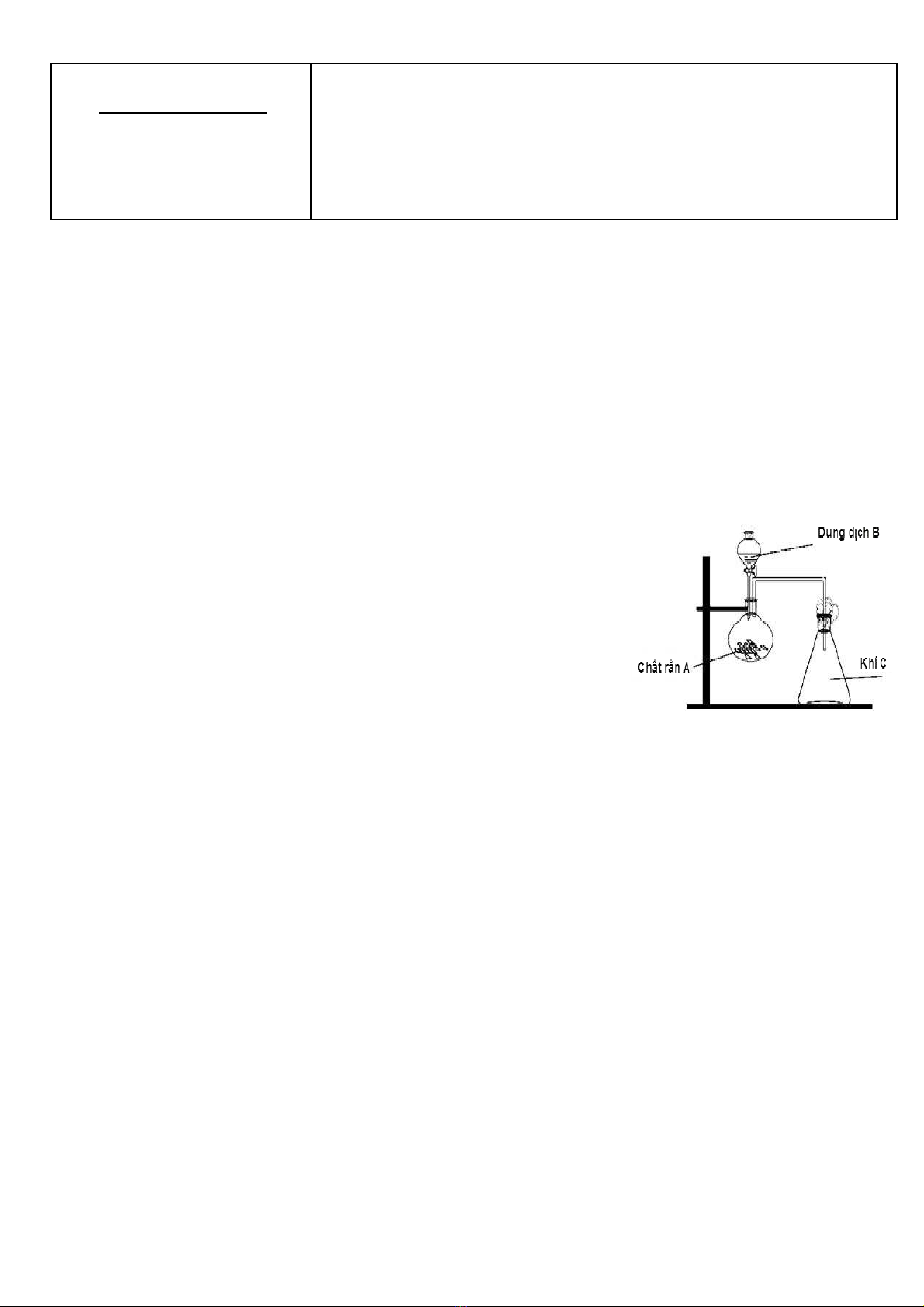
2. Trong phòng thí nghi m, b d ng c hình v bên có th dùng đệ ộ ụ ụ ở ẽ ể ể
đi u ch nh ng ch t khí nào trong s các khí sau: Clề ế ữ ấ ố 2, NO, NH3, SO2, CO2,
H2, C2H4? Gi i thích. M i khí đi u ch đc, hãy ch n m t c p ch t A vàả ỗ ề ế ượ ọ ộ ặ ấ
B thích h p đ vi t ph n ng đi u ch ch t khí đó.ợ ể ế ả ứ ề ế ấ
3. Cho Ba(OH)2 tác d ng v i dung d ch Hụ ớ ị 2SO4 thu đc k t t a A và dungượ ế ủ
d ch B. Cho B tác d ng v i kim lo i Al d thu đc dung d ch D và khí E.ị ụ ớ ạ ư ượ ị
S c khí COụ2 đn d vào dung d ch D th y t o k t t a F. Xác đnh ch tế ư ị ấ ạ ế ủ ị ấ
tan trong dung d ch B và vi t ph ng trình hóa h c c a các ph n ng x yị ế ươ ọ ủ ả ứ ả
ra.
Câu 3. (2,5 đi m)ể
1. Kh hoàn toàn 4,06 gam m t oxit kim lo i b ng CO nhi t đ cao thành kim lo i. D n toàn b s nử ộ ạ ằ ở ệ ộ ạ ẫ ộ ả
ph m khí sinh ra vào bình đng dung d ch Ca(OH)ẩ ự ị 2 d , th y t o thành 7 gam k t t a. N u l y l ng kimư ấ ạ ế ủ ế ấ ượ
lo i sinh ra hòa tan h t vào dung d ch HCl d thì thu đc 1,176 lít khí Hạ ế ị ư ượ 2 (đktc). Xác đnh công th c c a oxitị ứ ủ
kim lo i. ạ
2. Đt cháy hoàn toàn m gam m t m u than ch a 4% t p ch t tr b ng khí oxi thu đc 11,2 lít h n h p Aố ộ ẫ ứ ạ ấ ơ ằ ượ ỗ ợ
g m 2 h p ch t khí (đktc). S c t t A vào 200ml dung d ch h n h p Ba(OH)ồ ợ ấ ụ ừ ừ ị ỗ ợ 2 1M, sau ph n ng thu đcả ứ ượ
29,55 gam k t t a. ế ủ
a. Vi t ph ng trình hóa h c c a các ph n ng x y ra.ế ươ ọ ủ ả ứ ả
b. Tính m và th tích khí oxi (đktc) đã dùng.ể
3. Lên men p gam glucoz đ t o thành ancol etylic (hi u su t ph n ng b ng 90%). H p th hoàn toànơ ể ạ ệ ấ ả ứ ằ ấ ụ
l ng khí COượ 2 sinh ra vào dung d ch Ca(OH)ị2 d , thu đc 15 gam k t t a. Vi t ph ng trình hóa h c c aư ượ ế ủ ế ươ ọ ủ
các ph n ng x y ra và tính giá tr p. ả ứ ả ị
Câu 4. (2,0 đi m)ể
1. Cho h p ch t h u c Y ch a C, H, O. Đt cháy h t 0,2 mol Y c n v a đ 8,96 lít khí Oợ ấ ữ ơ ứ ố ế ầ ừ ủ 2 (đktc). Cho toàn
b s n ph m cháy l n l t đi ch m qua bình 1 đng 100 gam dung d ch Hộ ả ẩ ầ ượ ậ ự ị 2SO4 96,48% (d ), bình 2 đngư ự
dung d ch KOH (d ), th y s n ph m cháy b h p th hoàn toàn. Sau thí nghi m, n ng đ dung d ch Hị ư ấ ả ẩ ị ấ ụ ệ ồ ộ ị 2SO4 ở
bình 1 là 90%, bình 2 có 55,2 gam mu i t o thành. Xác đnh công th c phân t và vi t công th c c u t oở ố ạ ị ứ ử ế ứ ấ ạ
c a Y. Bi t r ng khi cho Y tác d ng v i dung d ch KHCOủ ế ằ ụ ớ ị 3 thì gi i phóng khí COả2.

2. Đt cháy hoàn toàn 4,872 gam m t hiđrocacbon X, h p th hoàn toàn s n ph m cháy vào bình đng dungố ộ ấ ụ ả ẩ ự
d ch n c vôi trong. Sau ph n ng, thu đc 27,93 gam k t t a và th y kh i l ng dung d ch gi m 5,586ị ướ ả ứ ượ ế ủ ấ ố ượ ị ả
gam. Xác đnh công th c phân t c a X.ị ứ ử ủ
(Cho Ag=108; K=39; C=12; H=1; Ca=40; Fe=56; Cu=64; Al=27; Zn=65; N=14; Na = 23; Ba=137)
---------------------H t-------------------ế
H NG D N VÀ ĐÁP ÁN CH MƯỚ Ẫ Ấ
Đ THI CH N HSG L P 9 THCS NĂM H C 201Ề Ọ Ớ Ọ 4-2015
Môn: HÓA
Khóa ngày 17-3-2015
Câu 1. (2,25 đi m)ể
1. (1,75 đi m)ể
a. Fe3O4 + 4H2SO4
Fe2(SO4)3 + FeSO4 + 4H2O (0,25đ)
b. C2H5OH + 3O2
2CO2 + 3H2O (0,25đ)
c. HCl + NaAlO2 + H2O
Al(OH)3 + NaCl
3HCl + Al(OH)3
AlCl3 + 3H2O (0,25đ)
d. SO2 + Br2 + 2H2O
H2SO4 + 2HBr (0,25đ)
e. Ba + 2H2O
Ba(OH)2 + H2
Ba(OH)2 + CuSO4
Cu(OH)2 + BaSO4(0,25đ)
f. H2S + Pb(NO3)2
PbS + 2HNO3(0,25đ)
g. (NH2)CO + 2H2O
(NH4)2CO3
(NH4)2CO3 + Ba(OH)2
BaCO3 + 2NH3 + 2H2O (0,25đ)
2. (0,5 đi m)ể
PTHH:
Na + H2O
NaOH + 1/2H2
Na + C2H5OH
C2H5ONa + 1/2H2(0,25đ)
Đt s mol Hặ ố 2O và C2H5OH trong dung d ch etanol l n l t là x và y ị ầ ượ
18x + 46y = a
x + y = 0,04a
Ch n a = 100 ọ
x = 3 ; y = 1
C% c a dung d ch etanol = 46%ủ ị (0,25đ)
Câu 2. (3,25 đi m)ể
1. (1,25 đi m) ể
Đi u ch PVC:ề ế
C2H2 + HCl
0
2
HgCl , t
CH2=CHCl (0,25đ)
CH
2
CH
Cl
n
nCH
2
=CHCl t
0
, xt
(0,25đ)
Đi u ch cao su Buna:ề ế
2C2H2
0
4
CuCl, NH Cl, t
CH2=CH-CCH (0,25đ)
CH2=CH-CCH + H2
0
3
Pd/PbCO , t
CH2=CH-CH=CH2(0,25đ)

nCH
2
=CH-CH=CH
2
t
0
, p, xt
CH
2
CH CH CH
2
n
(0,25đ)
(N u không ghi rõ đi u ki n ph n ng ho c ghi sai thì đc ½ s đi m)ế ề ệ ả ứ ặ ượ ố ể
2. (1,0 đi m)ể
Gi i thích:ả Đ đi u ch đc khí C nh b d ng c v thì khí C ph i có đc đi m: n ng h n ể ề ế ượ ư ộ ụ ụ ẽ ả ặ ể ặ ơ
không khí (
M
= 29) và không tác d ng v i không khí. ụ ớ
Có th đi u ch đc các khí: Clể ề ế ượ 2, SO2, CO2. (0,25đ)
Ph n ng đi u ch : ả ứ ề ế
2KMnO4 + 16HCl
2KCl + 2MnCl2 + 5Cl2
+ 8H2O (0,25đ)
Na2SO3 + H2SO4 (loãng)
Na2SO4 + SO2
+ H2O (0,25đ)
CaCO3 + 2HCl
2NaCl + CO2
+ H2O (0,25đ)
(HS s d ng ph n ng khác n u đúng v n cho đi m t i đa)ử ụ ả ứ ế ẫ ể ố
3. (1,0 đi m)ể
T d ki n bài toán : s c COừ ữ ệ ụ 2 đn d vào dung d ch D có k t t a t o thành nên ta xác đnh đcế ư ị ế ủ ạ ị ượ
trong dung d ch B ch a Ba(OH)ị ứ 2 d . ư(0,25đ)
Các ch t A,B,D,E,F l n l t là: BaSOấ ầ ượ 4, Ba(OH)2 , Ba(AlO2)2, H2, Al(OH)3
Các ph ng trình ph n ng:ươ ả ứ
Ba(OH)2 + H2SO4 BaSO→4 + 2H2O (0,25đ)
2Al + Ba(OH)2 + 2H2O Ba(AlO→2)2 + 3H2↑(0,25đ)
2CO2 + Ba(AlO2)2 + 4H2O 2Al(OH)→3 + Ba(HCO3)2(0,25đ)
Câu 3. (2,5 đi m)ể
1. (0,75 đi m)ể
Đt công th c oxit là Aặ ứ xOy , s mol là a molố
PTHH:
AxOy + yCO
xA + yCO2 (1); CO2 + Ca(OH)2
CaCO3 + H2O (2)
2A + 2nHCl
2ACln + nH2 (3) (0,25đ)
Ta có: a.(A.x + 16y) = 4,06
ay= 0,07
axn/2 = 1,176/22,4 = 0,0525
A.0,105/n +16.0,07=4,06
A=28.n
n =2, A = 56
A là Fe (0,25đ)
y/x = 0.07/0,0525 =4/3
Công th c oxit là: Feứ3O4 (0,25đ)
2. (1,0 đi m)ể
Ph ng trình ph n ngươ ả ứ
C + O2
o
t
CO2 (1)
2C + O2
o
t
2CO (2) (0,25đ)
CO2 + Ba(OH)2
BaCO3 + H2O (3)
Có th có ph n ng: COể ả ứ 2 + BaCO3 + H2O
Ba(HCO3)2 (4)
2 3
( )
11, 2 29,55
0,5( ); 0, 2.1 0, 2( ); 0,15( )
22, 4 197
= = = = = =
A Ba OH BaCO
n mol n mol n mol
H n h p A g m 2 h p ch t khí là CO và COỗ ơ ồ ơ ấ 2
Theo ph ng trình (1) và (2) ta có: ươ
2
0,5( )
100
0,5.12. 6, 25
96
C CO CO
n n n mol
m gam
= + =
= =
(0,25đ)
M t khác, ặ
3 2
( )BaCO Ba OH
n n<
Khi s c A vào dung d ch Ba(OH)ụ ị 2 có hai tr ng h p x y ra:ườ ợ ả

Tr ng h p 1ườ ợ : Có ph n ng (3), không có ph n ng (4).ả ứ ả ứ
2 3
( )
0,15( )
0,5 0,15 0,35( )
CO BaCO
CO trongA
n n mol
n mol
= =
= − =
T (1) và (2) ừ
2 2
O (phᄊn ᄊng) CO CO
1 1
n =n + n =0,15+ .0,35 = 0,325 (mol)
2 2
2
0,325.22, 4 7, 28
O
V= =
lít. (0,25đ)
Tr ng h p 2ườ ợ : Có x y ra ph n ng (4)ả ả ứ
CO2 + Ba(OH)2
BaCO3 + H2O (3)
0,2
0,2
0,2
CO2 + BaCO3 + H2O
Ba(HCO3)2 (4)
0,05
(0,2-0,15)
2
0, 2 0, 05 0, 25( ) = + =
CO
n mol
( )
0,5 0, 25 0, 25( ) = − =
CO trongA
n mol
2
( )
0, 25
(0, 25 ).22, 4 8, 4
2
= + =
O phanung
V lit
(0,25đ)
3. (0,75 đi m)ể
PTHH:
men rᄊᄊu
6 12 6 2 5 2
2 2C H O C H OH CO +
CO2 + Ca(OH)2
CaCO3 + H2O (0,25đ)
2 3
0,15
CO CaCO
n n mol= =
glucozᄊ
0,15/ 2 0,075 n mol= =
(0,25đ)
glucozᄊ
0,075.180.100 / 90 15 gamm= =
= p (0,25đ)
Câu 4. (2,0 đi m)ể
1. (1,0 đi m)ể
S mol Oố2 cháy =
4,22
96,8
= 0,4 mol ;
Kh i l ng Hố ượ 2SO4 = 96,48 gam, sau khi h p th Hấ ụ 2O thì kh i l ng Hố ượ 2SO4 trong dung d ch khôngị
đi ổ
Kh i l ng dung d ch sau khi h p th = ố ượ ị ấ ụ
100
90
48,96
= 107,2 gam
Kh i l ng Hố ượ 2O thu đc sau khi đt ch t h u c = kh i l ng dung d ch Hượ ố ấ ữ ơ ố ượ ị 2SO4 tăng = 7,2 gam
S mol Hố2O =
18
2,7
= 0,4 mol (0,25đ)
Khi cho CO2 vào dung d ch KOH d ta có PT: 2KOH + COị ư 2 K2CO3 + H2O (1)
T (1) ta có s mol COừ ố 2 = s mol Kố2CO3 =
138
2,55
= 0,4 mol
G i Y là CọxHyOz
Ta có PT cháy: CxHyOz +
4
24 zyx
O2 xCO2 +
2
y
H2O (2)
1 mol x mol y/2 mol
0,2 mol 0,4 mol 0,4 mol
x = 2; y = 4 (0,25đ)
Áp d ng ĐLBTNT v i nguyên t Oxi ta có:ụ ớ ố

S nguyên t Oố ử (trong 0,2 mol Y) + s ng t Oố ử (cháy) = s ng t Oố ử (trong CO2) + s ng t Oố ử (trong H2O)
0,2z + 20,4 = 20,4 + 0,4 z = 2 V y CTPT c a Y là: Cậ ủ 2H4O2 (0,25đ)
Vì Y tác d ng v i KHCOụ ớ 3 t o COạ2 nên Y ph i có nhóm –COOH ả
V y CTCT c a Y là CHậ ủ 3COOH.
CH3COOH + KHCO3 CH3COOK + CO2 + H2O (0,25đ)
2.(1,0 đi m)ể
Đt công th c phân t c a X là Cặ ứ ử ủ xHy:
CxHy +
2
2
x y+
O2
xCO2 +
2
y
H2O
Khi cho s n ph m cháy vào dung d ch Ca(OH)ả ẩ ị 2 thì c Hả2O và CO2 đu b h p th , đng th i t oề ị ấ ụ ồ ờ ạ
thành k t t a tách ra kh i dung d ch.ế ủ ỏ ị
2 2
2 2 2 2
dd giᄊm kᄊt tᄊa CO H O
CO H O CO H O
( )
22,344 44 18 vᄊi n vᄊ n
m m m m
m m a b a b
= − +
+ = = + = =
(0,25đ)
M t khác, b o toàn kh i l ng , ta có: ặ ả ố ượ
12 2 4,872
X C H
m m m a b= + = + =
(0,25đ)
Gi i h ph ng trình , ta có: a = 0,336 ; b = 0,42ả ệ ươ
X là ankan (0,25đ)
S nguyên t C trong X = ố ử
2
CO
X
n0,336
= = 4
n 0,42-0,336
X là C4H10. (0,25đ)
L u ý:ư
-Thí sinh có th gi i nhi u cách, n u đúng v n đc đi m t i đa.ể ả ề ế ẫ ượ ể ố
-N u bài toán gi i h p lí mà thi u ph ng trình hóa h c thì thí sinh v n đc tính k t quế ả ợ ế ươ ọ ẫ ượ ế ả
ch m t đi m vi t ph ng trìnhỉ ấ ể ế ươ
-Đi m chi t ph i đc t th ng nh t; đi m toàn bài chính xác đn 0,25 đi m.ể ế ả ượ ổ ố ấ ể ế ể












![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



