
1
SỞ GIÁO DỤ C VÀ ĐÀO TẠ O
THÀNH PHỐ ĐÀ NẴ NG
HƯ Ớ NG DẪ N CHẤ M KÌ THI HỌ C SINH GIỎ I THÀNH PHỐ
NĂM HỌ C 2004 - 2005
MÔN: HÓA HỌ C LỚ P 11
Thờ i gian: 150 phút (không kể thờ i gian giao đề )
Câu I M (3 điể m)
1. Hãy so sánh và giả i thích sự khác nhau về độ phân cự c phân tử, nhiệ t độ sôi và độ mạ nh tính bazơ
giữ a NH3 và NF3.
2. N2O4 phân li 20,0% thành NO2ở 27oC và 1,00 atm. Hãy xác đị nh (a) giá trị Kp; (b) độ phân li củ a
N2O4 tạ i 27oC và 0,10 atm; (c) độ phân li củ a 69g N2O4 trong bình 20 L ở 27oC.
3. Tính pH củ a dung dị ch thu đư ợ c khi thổ i hế t 224 mL khí CO2 vào 200 mL dung dị ch NaOH 0,05M,
biế t axit cacbonic có
35,6pK 1a
,
33,10pK 2a
.
ĐÁP ÁN
ĐIỂ M
1. Cấ u tạ o:
N
HH
H
N
FF
F
-NH3 phân cự c hơn NF3 do trong NH3 lư ỡ ng cự c liên kế t và lư ỡ ng cực electron tự
do cùng chiề u, còn trong NF3 lư ỡ ng cự c liên kế t và lư ỡ ng cự c electron tự do ngư ợ c
chiề u.
-Nhiệ t độ sôi củ a NH3 cao hơn do NH3 tạ o đư ợ c liên kế t H liên phân tử.
-NH3là mộ t bazơ còn NF3 thì không, do trong NF3 các nguyên tử F hút electron
làm giả m mậ t độ electron trên nguyên tử N.
2. Xét phả n ứ ng phân li:
N2O42NO2
n 0
n2n
n-n2n
Phầ n mol:
1
1
1
2
,
P
1
4
P
P
P
K2
2
ON
2
NO
ON
2
NO
P
42
2
42
2
(a)
17,01
)2,0(1
)2,0(4
P
1
4
K2
2
2
2
P
(b)
%)6,54(546,017,010,0
1
4
2
2
(c)
mol75,0
92
69
n
)1(9225,0
20
300082,0)1(75,0
P42ON
845,1
20
300082,0.75,0.2
P2
NO
17,0
)1(9225,0
)845,1(
K
2
P
%)27,19(1927,0
0,75
(0,25
3)
1,50
(0,50
3)

2
3.
01,005,02,0n,mol01,0
4,22
224,0
nNaOHCO2
Vì số mol CO2 và NaOH bằ ng nhau nên hệ chỉ chứ a NaHCO3. Có thể tính pH củ a hệ
lư ỡ ng tính này bằ ng công thứ c:
3,833,1035,6
2
1
)pKpK(
2
1
pH 21
0,75
(0,25+0,5)
Câu II (3 điể m)
1. Viế t phư ơ ng trình phả n ứ ng xả y ra khi cho NH4Cl tác dụ ng vớ i CuO và vớ i ZnO. Cho biế t ứ ng
dụ ng thự c tế củ a NH4Cl tư ơ ng ứ ng vớ i các phả n ứ ng này.
2. Hòa tan 10,00 g hỗ n hợ p gồ m Cu2S và CuS bằ ng 200,0 mL dung dị ch MnO4- 0,7500 M trong môi
trư ờ ng axit. Sau khi đun sôi để đuổ i hế t khí SO2 sinh ra, lư ợ ng MnO4- còn dư trong dung dị ch phả n
ứ ng vừ a hế t vớ i 175,0 mL dung dị ch Fe2+ 1,000 M.
(a) Viế t các phư ơ ng trình phả n ứ ng xả y ra (dạ ng phư ơ ng trình ion thu gọ n).
(b) Tính phầ n trăm khố i lư ợ ng CuS trong hỗ n hợ p ban đầ u.
ĐÁP ÁN
ĐIỂ M
1. Trong thự c tế , NH4Cl đư ợ c dùng để đánh sạ ch bề mặ t kim loạ i trư ớ c khi hàn:
4CuO + 2NH4Cl N2 + 3Cu + CuCl2 + 4H2O
ZnO + 2NH4Cl ZnCl2 + 2NH3 + H2O
2. (a) Phư ơ ng trình phả n ứ ng:
5Cu2S + 8MnO4-+ 44H+ 10Cu2+ + 5SO2 + 8Mn2+ + 22H2O (1)
5CuS + 6MnO4-+ 28H+ 5Cu2+ + 5SO2 + 6Mn2+ + 14H2O (2)
5Fe2+ + MnO4- + 8H+ 5Fe3+ + Mn2+ + 4H2O (3)
(b) Xác đị nh %
(1)
mol035,01175,0
5
1
n
5
1
n2
4Fe)3(MnO
mol115,0035,075,02,0n )2,1(MnO4
Đặ t số mol Cu2S và CuS lầ n lư ợ t là x và y, ta có:
0625,0y
025,0x
115,0y
5
6
x
5
8
10y96x160
%60%100
10
960625,0
m% SCu
1,50
(0,50
3)
0,75
(0,25
3)
0,75
Câu III (4 điể m)
1. Chỉ dùng chấ t chỉ thị phenolphtalein, hãy phân biệ t các dung dị ch NaHSO4, Na2CO3, AlCl3,
Fe(NO3)3, NaCl, Ca(NO3)2. Các phả n ứ ng minh họ a viế t dư ớ i dạ ng ion thu gọ n.
2. Hòa tan hế t 2,2 g hỗ n hợ p kim loạ i A gồ m sắ t và nhôm trong 150 mL dung dị ch HNO3 2M thu
đư ợ c dung dị ch B và 448 mL (đktc) khí C gồ m N2O và N2 có tỉ khố i so vớ i không khí bằ ng 1,2414.
Thêm 13,6 g NaOH nguyên chấ t vào dung dị ch B thu đư ợ c kế t tủ a D, lọ c kế t tủ a D thu đư ợ c dung
dị ch nư ớ c lọ c E.
(a) Tính phầ n trăm khố i lư ợ ng mỗ i kim loạ i trong hỗ n hợ p A ban đầ u.
(b) Nung kế t tủ a D đế n khố i lư ợ ng không đổ i thì thu đư ợ c bao nhiêu gam chấ t rắ n khan?
(c) Tính thể tích dung dị ch HCl 0,5M cầ n thêm vào dung dị ch E để thu đư ợ c 2,34 g kế t tủ a.

3
ĐÁP ÁN
ĐIỂ M
1. Trích mẫ u thử cho mỗ i lầ n thí nghiệ m:
Cho phenolphtalein vào mỗ i mẫ u thử. Mẫ u thử có màu hồ ng là dung dị ch Na2CO3,
các mẫ u thử còn lạ i không màu.
CO32- + H2O HCO3- + OH-
Dùng Na2CO3 làm thuố c thử để cho vào các mẫ u thử còn lạ i.
Mẫ u thử có sủ i bọ t khí không màu là NaHSO4
CO32- + 2H+ H2O + CO2↑
Mẫ u thử tạ o kế t tủ a trắ ng keo và sủ i bọ t khí không màu là AlCl3
2Al3+ + 3CO32- + 3H2O 2Al(OH)3↓+ 3CO2↑
Mẫ u thử tạ o kế t tủ a đỏ nâu và sủ i bọ t khí không màu là Fe(NO3)3
2Fe3+ + 3CO32- + 3H2O 2Fe(OH)3↓+ 3CO2↑
Mẫ u thử tạ o kế t tủ a trắ ng là Ca(NO3)2
Ca2+ + CO32- CaCO3↓
Mẫ u thửkhông tạ o hiệ n tư ợ ng là NaCl.
2. (a) Đặ t số mol N2O và N2 lầ n lư ợ t bằ ng a và b, ta có:
01,0ba
36292414,1
02,0
b28a44
02,0
4,22
448,0
ba
Đặ t số mol Fe và Al lầ n lư ợ t bằ ng x và y
Chấ t khửChấ t oxi hóa
Fe - 3e Fe3+ 10H+ + 2NO3- + 8e N2O + 5H2O
3x x 0,10 0,08
Al - 3e Al3+ 12H+ + 2NO3- + 10e N2 + 6H2O
3y y 0,12 0,10
Vì
mol3,0)bd(nmol22,0)pu(n HH
nên axit dư, phả n ứ ng không tạ o Fe2+.
Ta có:
04,0y
02,0x
18,0y3x3
2,2y27x56
Vậ y
%9,50%100
2,2
5602,0
m% Fe
và
%1,49m% Al
(b) Thêm NaOH vào dung dị ch B [H+ (0,15.2-0,22 = 0,08 mol), Fe3+ (x = 0,02 mol),
Al3+ (y = 0,04 mol) và NO3-]
H+ + OH- H2O (1)
Fe3+ + 3OH- Fe(OH)3(2)
Al3+ + 3OH- Al(OH)3(3)
Al(OH)3 + OH- AlO2- + 2H2O (4)
mol34,0
40
6,13
nmol3,0n4n3nn )bd(OHAlFeH)4,3,2,1(OH 33
sau (1), (2), (3), (4) vẫn còn dư OH-, kế t tủ a D là Fe(OH)3 (0,02mol)
2Fe(OH)3 Fe2O3 + 3H2O, mrắ n =
g6,116001,0m 32OFe
(c) Thêm HCl vào dung dị ch E [Na+, OH- (0,04 mol), AlO2- (0,04 mol) và NO3-]
OH- + H+ H2O (5)
AlO2- + H+ + H2O Al(OH)3(6)
Al(OH)3 + 3H+ Al3+ + 3H2O (7)
mol03,0
78
34,2
n3
)OH(Al
1,50
(0,25
6)
1,00
0,50
4
Trư ờ ng hợ p 1: Xả y ra (5), (6) và AlO2- dư
mol07,003,004,0nnn 3
)OH(Al
OHH
,
L14,0
5,0
07,0
V
Trư ờ ng hợ p 2: Xả y ra (5), (6), (7)
mol01,003,004,0n )7()OH(Al 3
mol11,003,004,004,0n3nnn )7()OH(Al
AlOOHH 3
2
L22,0
5,0
11,0
V
1,00
(0,50
2)
Câu IV (3 điể m)
1. Tính hiệ u ứ ng nhiệ t phả n ứ ng hidro hóa etilen tạ o etan, biế t nhiệ t cháy củ a C2H6 và C2H4 lầ n lư ợ t
bằ ng -368,4 kcal/mol và -337,2 kcal/mol [sả n phẩ m cháy là CO2(k) và H2O (l)], nhiệ t hình thành
H2O (l) là -68,32 kcal/mol.
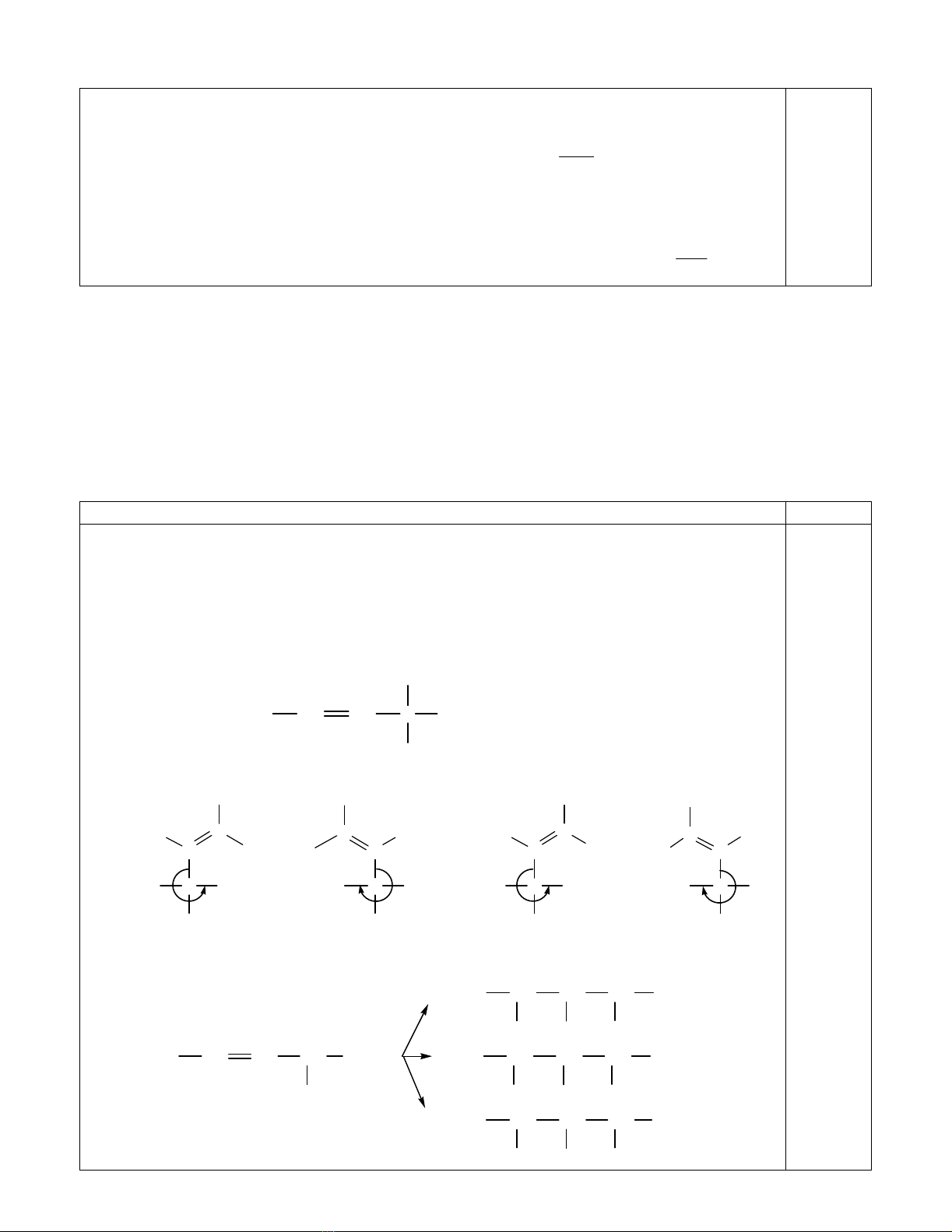
2. (a) Viế t công thứ c cấ u tạ o và gọ i tên anken ít cacbon nhấ t đồ ng thờ i có đồ ng phân hình họ c và đồ ng
phân quang họ c. (b) Viết các đồ ng phân hình họ c và quang họ c ứ ng vớ i cấ u tạ o đó (sử dụ ng công
thứ c Fisher) và xác đị nh cấ u hình mỗ i đồ ng phân (Z/E và R/S). (b) Viế t cấ u tạ o các sả n phẩ m chính
hình thành khi cho anken trên tác dụ ng vớ i dung dị ch nư ớ c brom có lư ợ ng nhỏ muố i natri clorua.
ĐÁP ÁN
ĐIỂ M
1. (1) C2H6 (k) + 7/2O2 (k) 2CO2 (k) + 3H2O (l)
kcal4,368H
(2) C2H4 (k) + 3O2 (k) 2CO2 (k) + 2H2O (l)
kcal2,337H
(3) H2 (k) + 1/2O2 (k) H2O (l)
kcal32,68H
Lấ y (2) - (1) + (3) ta đư ợ c:
C2H4 (k) + H2 (k) C2H6 (k)
kcal1,37)32,68()4,368()2,337(H
2. (a) Cấ u tạ o:
CH3CH CH C
H
CH3
C2H5(4-metylhex-2-en)
(b) Cấ u hình:
C
C
CH3
H
C2H5
C
H
HCH3
C
C
HCH3
C2H5
C
C
CH3
H
C2H5
C
CH3
HH
C
C
HCH3
C2H5
H
H
C
CH3
H
CH3
C
H
(E)(R) (E)(S)
(Z)(R) (Z)(S)
(c) Cấ u tạ o các sả n phẩ m:
CH3CH CH CH
CH3
C2H5
CH3CH CH CH
CH3
C2H5
Br Br
CH3CH CH CH
CH3
C2H5
OH Br
CH3CH CH CH
CH3
C2H5
Cl Br
1,00
0,25
1,00
(0,25
4)
0,75
(0,25
3)
5
Câu V (3 điể m)
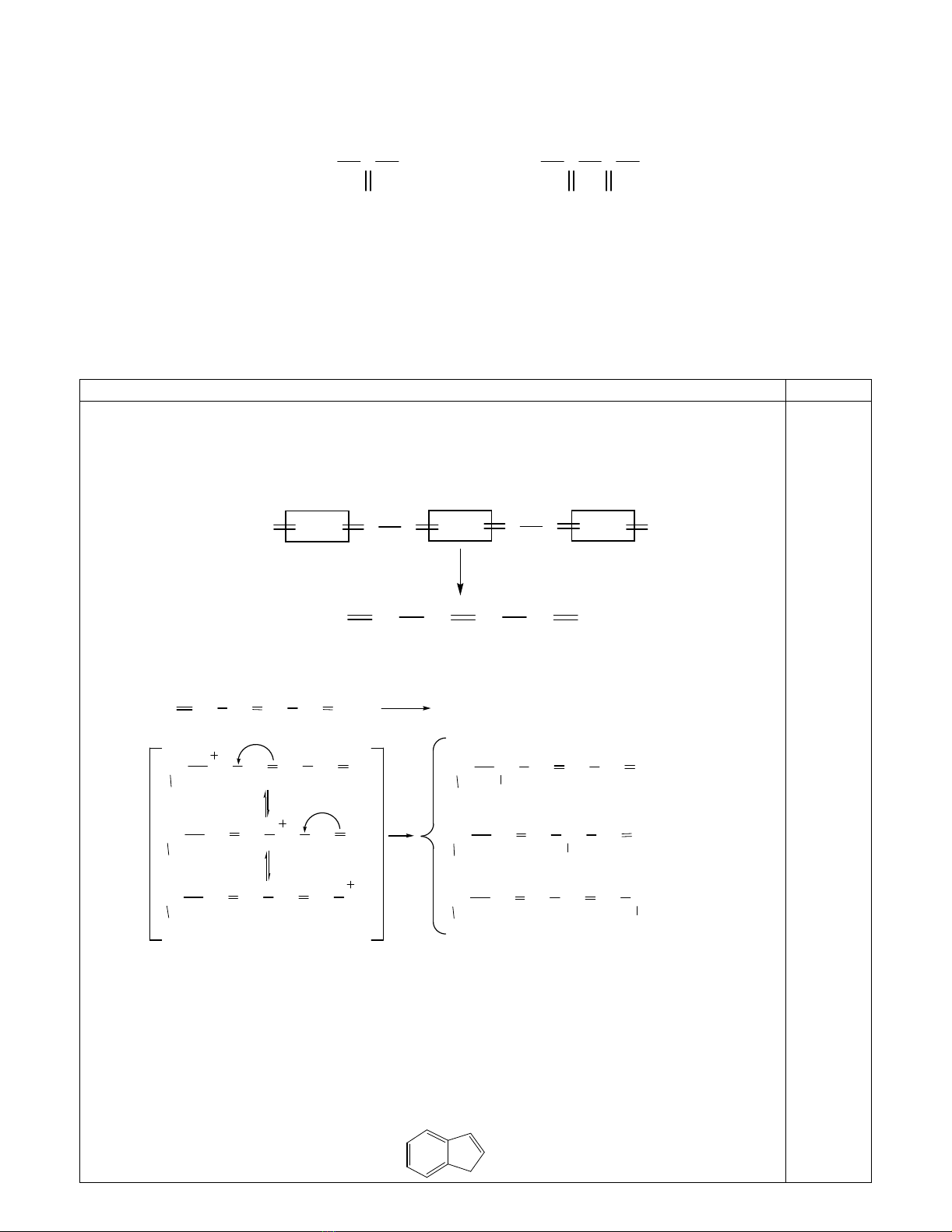
1. Hidrocacbon A có khố i lư ợ ng phân tử bằ ng 80. Ozon phân A chỉ tạ o andehit fomic và andehit
oxalic.
CH
O
H CH
O
C
O
H
andehit fomic andehit oxalic
(a) Xác đị nh cấu tạ o và gọ i tên A.
(b) Dùng cơ chế giải thích các sả n phẩ m hình thành khi cộ ng Br2 vào A theo tỉ lệ mol 1:1, gọ i tên
các sả n phẩ m này.
2. Hợ p chấ t A có công thứ c phân tử C9H8. A làm mấ t màu Br2 trong CCl4; hidro hóa A trong điề u kiệ n
êm dị u tạ o ra C9H10, còn trong điề u kiệ n nhiệ t độ và áp suấ t cao thì tạ o ra C9H16; oxi hóa mãnh liệ t
A sinh ra axit phtalic [1,2-C6H4(COOH)2]. Lậ p luậ n xác đị nh cấ u tạ o củ a A.
ĐÁP ÁN
ĐIỂ M
1. (a) Công thứ c tổ ng quát cho A là CxHy
Ta có
8y
6x
2x2y
80yx12
, công thứ c phân tử C6H8
)3(
Từ sả n phẩ m ozon phân ta thu đư ợ c cấ u tạ o củ a A:
CH2CH CH CH CH CH2
H2C O O H
CH
COOH
CH
COO CH2
A (hexa-1,3,5-trien)
(b) Cơ chế và sả n phẩ m:
CH2CH CH CH CH CH2
Br2
CH2CH CH CH CH CH2
CH2CH CH CH CH CH2
Br
Br
CH2CH CH CH CH CH2
Br
CH2CH CH CH CH CH2
CH2CH CH CH CH CH2
Br
Br
CH2CH CH CH CH CH2
Br
Br
Br
Br
(X) 5,6-dibromhexa-1,3-dien; (Y) 3,6-dibromhexa-1,4-dien;
(X)
(Y)
(Z)
(Z) 1,6-dibromhexa-2,4-dien
2. A (C9H8) có độ bấ t bão hòa
6
A làm mấ t màu Br2 và cộ ng êm dị u 1 phân tử H2cho thấ y A có 1 liên kế t đôi.
A cộ ng tố i đa 4 phân tửH2và khi oxi hóa tạ o axit phtalic cho thấ y A có vòng benzen và
ngoài ra còn mộ t vòng 5 cạ nh nữ a.
Công thứ c củ a A:
0,50
0,50
(0,25
2)
1,50
(0,50
3)
0,50










![Đề Thi Học Sinh Giỏi Hóa 11 Thành Phố Đà Nẵng [2005-2006] - Tuyển Tập Đề Thi](https://cdn.tailieu.vn/images/document/thumbnail/2010/20100913/trungtran5/135x160/_hoahoc11_thihsgthanhphodanang_2006_2007_4413.jpg)











![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



