vietnam medical journal n02 - APRIL - 2020
36
TỐI ƯU QUY TRÌNH ONE-STEP REALTIME RT-PCR ĐỊNH LƯỢNG HBV-
RNA HUYẾT THANH Ở BỆNH NHÂN VIÊM GAN VI RÚT B MẠN TÍNH
Hoàng Xuân Cường1, Đỗ Như Bình1,2, Đỗ Tuấn Anh1,2;
Hoàng Vũ Hùng1,2, Đào Văn Thắng1,2, Trần Viết Tiến1,2
TÓM TẮT10
Nhiễm vi rút viêm gan B (Hepatitis B virus - HBV)
là một vấn đề y tế toàn cầu và bệnh gan do nhiễm
mạn tính HBV vẫn là gánh nặng khổng lồ đối với toàn
xã hội. Hiện nay, các loại thuốc kháng vi rút tương tự
nucleoside như Lamivudin, Adefovir, Telbivudine… chỉ
ức chế quá trình phiên mã ngược tổng hợp DNA của
HBV nhưng không ảnh hưởng đến quá trình tổng hợp
RNA tiền thể gen (pregenomic RNA) và các loại RNA
thông tin khác từ cccDNA. Do vậy, cần thiết phải định
lượng HBV-RNA trong huyết thanh bên cạnh HBV-
DNA, góp phần đánh giá hiệu quả điều trị và kiểm
soát tận gốc vi rút viêm gan B. Quy trình onestep
realtime – RT – PCR định lượng HBV-RNA huyết thanh
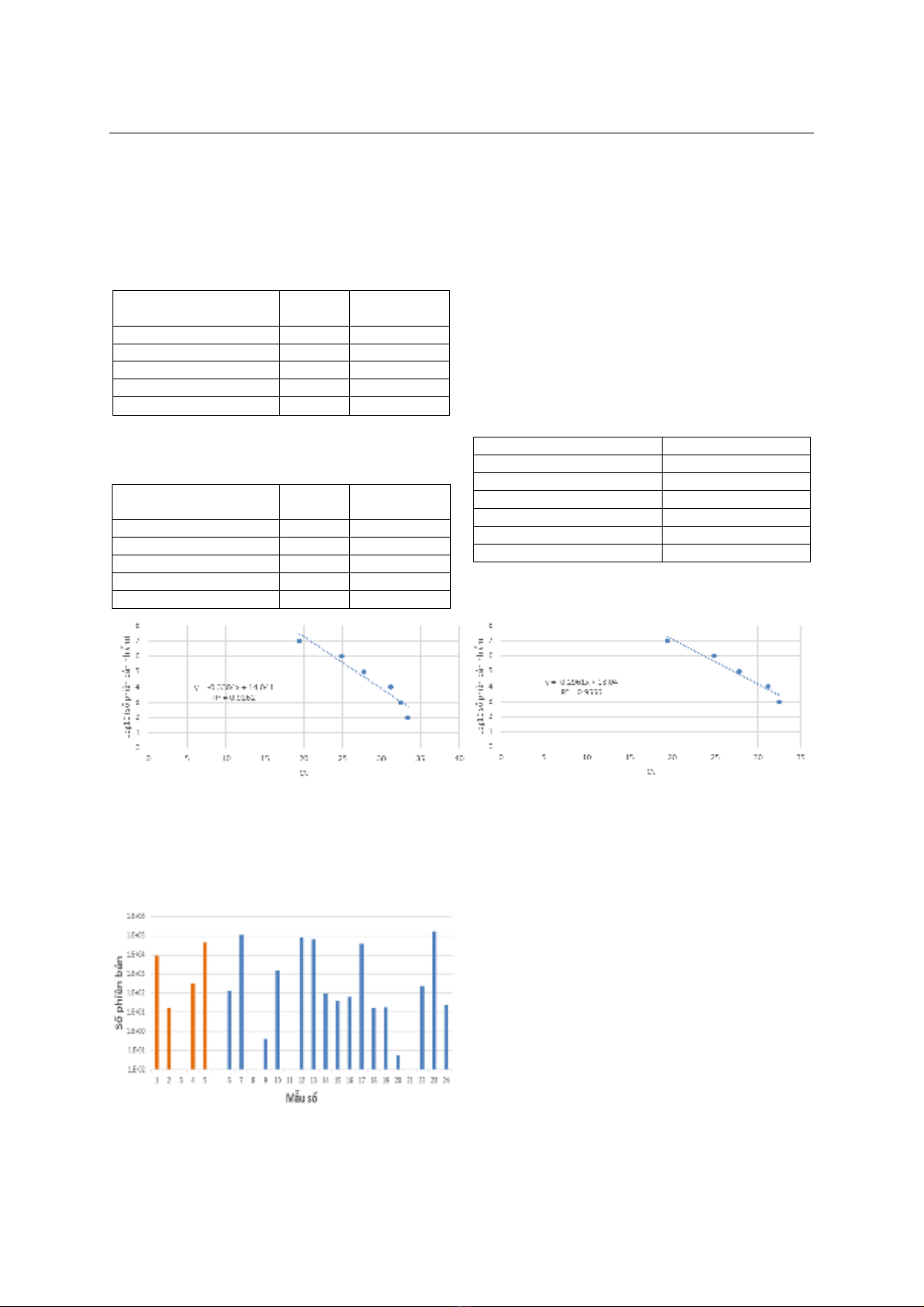
máu ngoại vi xây dựng được có độ nhạy của là 102
copies/ml và khoảng tuyến tính là 103 đến 107 copies/
ml với hệ số hồi quy là R2 = 0,9556.
Từ khóa:
Vi rút viêm gan B; RNA tiền thể gen;
DNA mạch vòng kín
SUMMARY
OPTIMIZING ONE-STEP REALTIME RT-PCR
METHOD FOR SERUM HBV-RNA QUANTIFICATION
IN PATIENTS WITH CHRONIC HEPATITIS B
Hepatitis B virus(HBV) infection is a global health
problem and chronic hepatitis B infection is still a huge
burden for worldwide. Currently, nucleoside analog
antiviral drugs such as Lamivudin, Adefovir,
Telbivudine... only inhibit reverse transcription
synthesis of HBV-DNA but do not affect the synthesis
of pregenomic RNA (pgRNA) and other types of
mesenger RNA from cccDNA. Therefore, it is
necessary to quantify HBV-RNA in serum besides HBV-
DNA, contributing to assessing the effectiveness of
treatment and radical control of the hepatitis B virus.
Onestep realtime RT - PCR protocol for serum HBV -
RNA quantitative was optimized that has a sensitivity
of 102 copies/ml and a linear range of 103 to 107
copies/ml with a regression coefficient of R2 = 0.9556.
Keywords:
Hepatitis B virus; pregenomic RNA;
covalently closed circular DNA
I. ĐẶT VẤN ĐỀ
Việt Nam nằm trong khu vực có tỉ lệ lưu hành
HBV trong cộng đồng vào loại cao nhất trên thế
giới [1], [2]. Hiện nay, để điều trị bệnh viêm gan
mạn tính, ở nước ta hiện thường sử dụng các loại
1Hc viện Quân y
2Bệnh viện Quân y 103
Chịu trách nhiệm chính: Đỗ Như Bình
Email: nhubinh.do@vmmu.edu.vn
Ngày nhận bài: 2/3/2020
Ngày phản biện khoa hc: 17/3/2020
Ngày duyệt bài: 25/3/2020
thuốc kháng vi rút tương tự nucleoside như
Lamivudin, Adefovir, Telbivudine, Entecavir và
Tenofovir. Tuy nhiên, một trong những vấn đề
của các loại thuốc tương tự nucleoside là chỉ ức
chế quá trình phiên mã ngược tổng hợp DNA của
HBV nhưng không ảnh hưởng đến quá trình tổng
hợp RNA tiền thể gen (pregenomic RNA) và các
loại RNA thông tin khác từ DNA mạch vòng kín
(cccDNA: covalently closed circular DNA) của HBV
trong nhân tế bào [3],[4]. Kết quả là RNA tiền thể
gen và các kháng nguyên bề mặt (HbsAg), kháng
nguyên lõi HbcAg và kháng nguyên HbeAg tiếp
tục được tạo ra [4],[5]. Do vậy, khi ngừng điều trị
liệu pháp sử dụng thuốc tương tự nucleoside quá
sớm (khi quá trình phiên mã tạo RNA tiền thể gen
và RNA thông tin khác vẫn diễn ra) sẽ làm bùng
phát bệnh, tạo ra nguy cơ xuất hiện các biến
chủng có khả năng kháng thuốc do enzym phiên
mã ngược không có hoạt tính sửa chữa. Bản thân
quá trình phiên mã tạo RNA thông tin mã hóa
polymerase của HBV từ cccDNA cũng tồn tại nguy
cơ tạo ra các thể đột biến kháng thuốc dưới áp
lực chn lc của thuốc kháng vi rút [6],[7]. Chính
vì những lý do này, nhiều nghiên cứu gần đây đã
chỉ ra rằng cần thiết phải định lượng HBV-RNA
trong huyết thanh bên cạnh HBV-DNA, góp phần
đánh giá hiệu quả điều trị và kiểm soát tận gốc vi
rút viêm gan B.
II. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
1. Đối tượng, vật liệu, hóa chất và thiết
bị nghiên cứu
1.1. Đối tượng nghiên cứu
- Đối tượng nghiên cứu là những bệnh nhân
viêm gan B mạn tính đã và chưa từng được điều
trị bằng thuốc nucles(t)ide analogue (NA) tại
khoa truyền nhiễm bệnh viện quân y 103.
- Nhóm chứng: là người khỏe mạnh bình
thường, không có bệnh lý về gan (dựa trên xét
nghiệm chức năng gan và dấu ấn vi rút).
1.2. Thiết bị, vật liệu nghiên cứu
- Hóa chất sinh phẩm chính: DNeasy Mini Kit
(Qiagen), RNeasy Mini Kit (Qiagen), PCR master
mix (Biotek), TaqMan Probes có gắn huỳnh quang
(Promega); SuperScript III Platium One-Step qRT-
PCR System (Invitrogen). Cặp mồi và mẫu dò Taq
Man theo nghiên cứu của Ying Liu và cs(2006) [8].
- Thiết bị nghiên cứu chính: Hệ thống Real-
time PCR Eppendorf Realplex4 (Qiagen), Máy ly