ANCOL - PHENOL
I - ANCOL
1. Công thức phân tử
Ancol là những hợp chất hữu cơ mà phân tử có nhóm hiđroxyl (
OH) liên kết
trực tiếp với nguyên tử cacbon no. CnH2n+2O; ROH; R(OH)n
Phân loại
- Theo bậc : ancol bậc I, II và III.
- Theo số nhóm chức : đơn và đa
- Theo gốc : no, không no, thơm
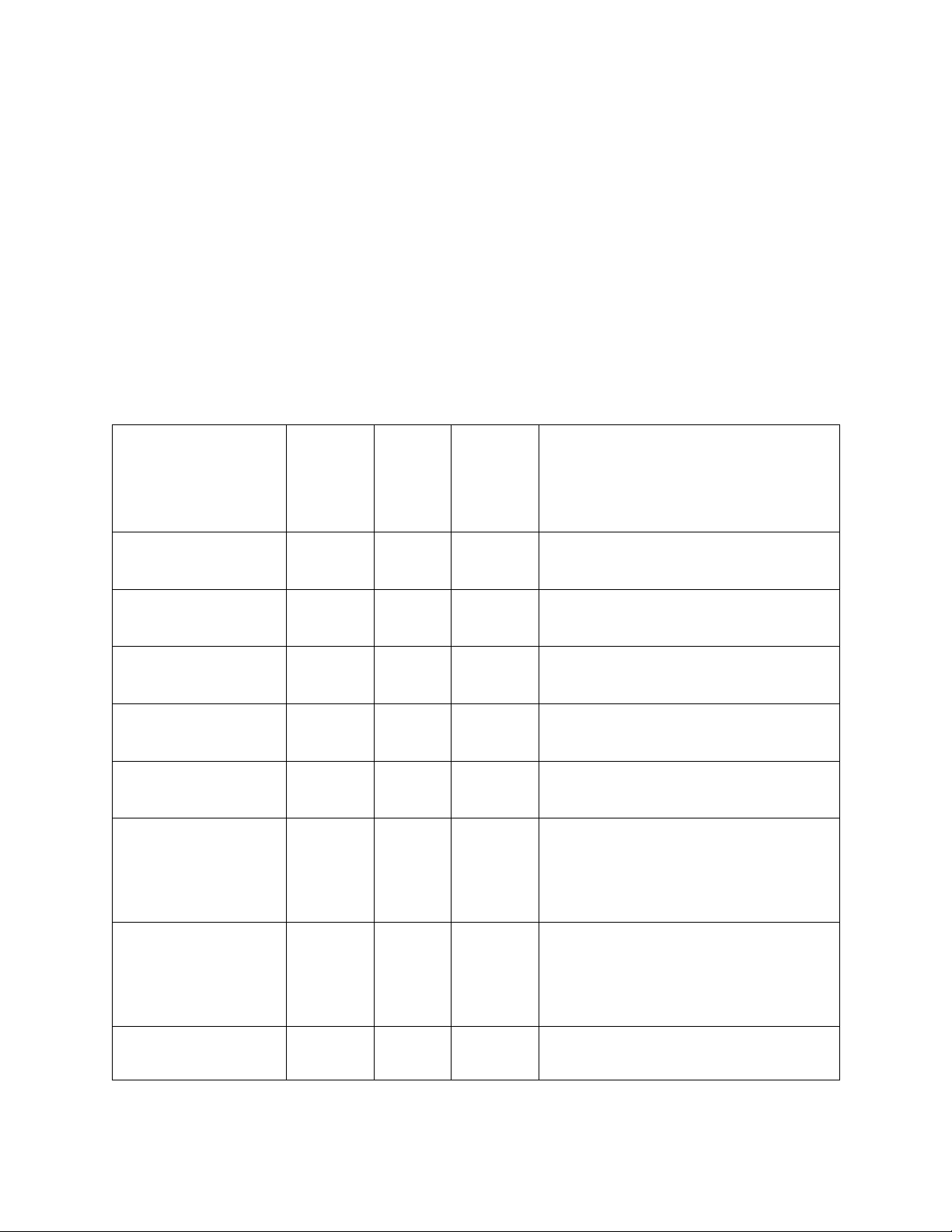
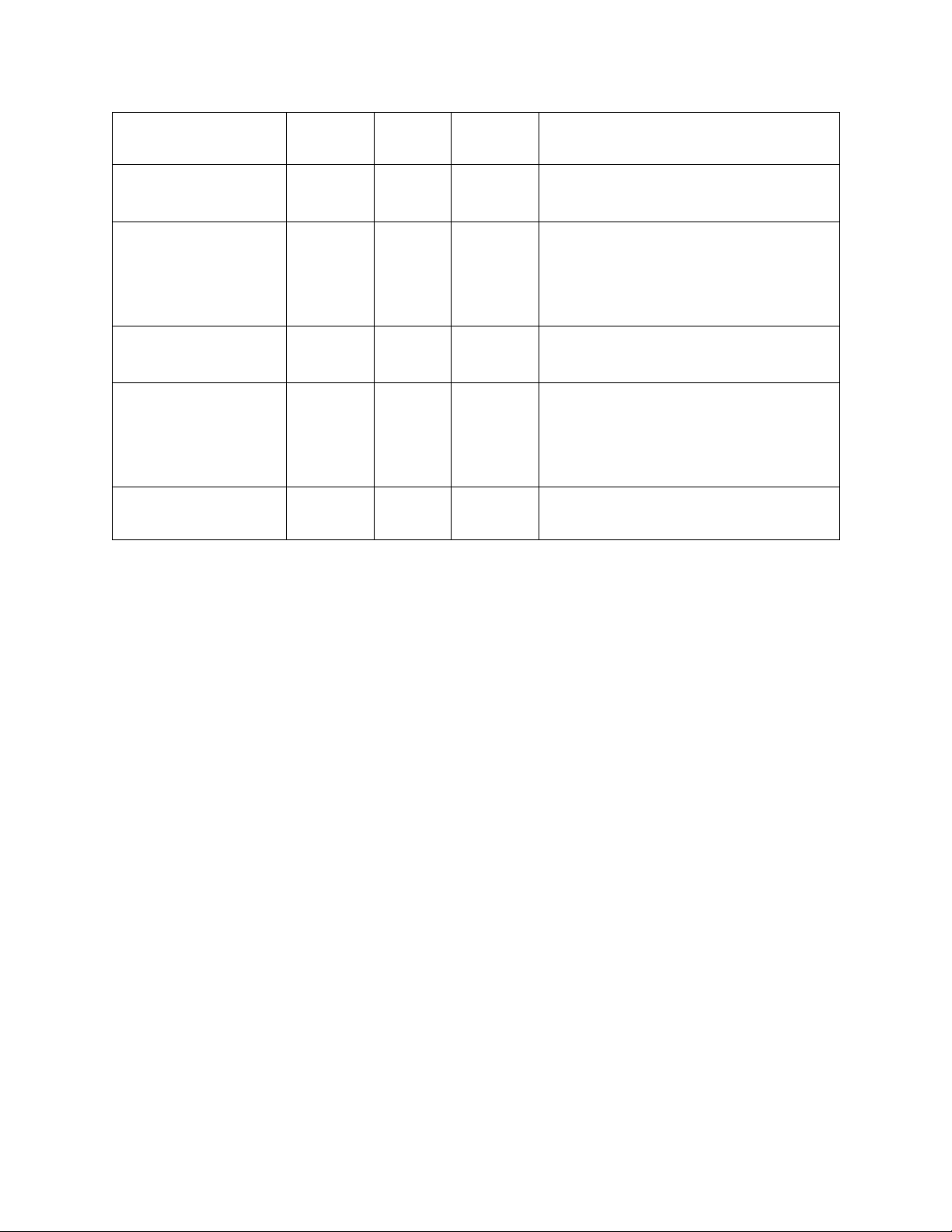
Ancol
Phân loại theo cấu
tạo
gốc hiđrocacbon
Phân loại theo theo số
lượng nhóm hiđroxyl
C2H5OH Ancol no, bậc I(*) Ancol đơn chức
(monoancol)
Xiclo – C6H11OH Ancol no, bậc II Ancol đơn chức
(monoancol)
(CH3)3COH Ancol no, bậc III Ancol đơn chức