
Bài 6: Đ D N ĐI N TRONG QUAN TR C M A ACIDỘ Ẫ Ệ Ắ Ư
I.T NG QUANỔ
1. M c đíchụ
Tìm hi u cách s d ng máy đo đ d nể ử ụ ộ ẫ
Tìm hi u ph ng pháp ki m ch ng đ tin c y c a s li u quan tr c m a acidể ươ ể ứ ộ ậ ủ ố ệ ắ ư
b ng đo đ d nằ ộ ẫ
2. Quá trình hình thành m a acid ư
Quá trình đ t s n sinh ra các khí đ c h i nh : l u huỳnh đioxit (SO2) và nitố ả ộ ạ ư ư ơ
đioxit (NO2). Các khí này hòa tan v i h i n c trong không khí t o thành các axitớ ơ ướ ạ
sunfuaric (H2SO4) và axit nitric(HNO3). Khi tr i m a, các h t axit này tan l n vào n cờ ư ạ ẫ ướ
m a, làm đ pH c a n c m a gi m. N u n c m a có đ pH d i 5,6 đ c g i làư ộ ủ ướ ư ả ế ướ ư ộ ướ ượ ọ
m a axit. Do có đ chua khá l n, n c m a có th hoà tan đ c m t s b i kim lo i vàư ộ ớ ướ ư ể ượ ộ ố ụ ạ
ôxit kim lo i có trong không khí nh ôxit chì,… làm cho n c m a tr nên đ c h n n aạ ư ướ ư ở ộ ơ ữ
đ i v i cây c i, v t nuôi và con ng i Trong thành ph n các ch t đ t t nhiên nh thanố ớ ố ậ ườ ầ ấ ố ự ư
đá và d u m có ch a m t l ng l n l u huỳnh, nit . Thông th ng, các quá trình sầ ỏ ứ ộ ượ ớ ư ơ ườ ử
d ng nhiên li u hóa th ch nh : các ph ng ti n giao thông, các nhà máy nhi t đi n dùngụ ệ ạ ư ươ ệ ệ ệ
than, các thi t b công nghi p, khai khoáng đ u t o ra m t l ng l n các khí SOx vàế ị ệ ề ạ ộ ượ ớ
Nox
3. Ph ng pháp quan tr c m a acidươ ắ ư
Trong quan tr c m a acid ng i ta l y m u n c m a, đo đ pH, đ d n đi nắ ư ườ ấ ẫ ướ ư ộ ộ ẫ ệ
riêng và xác đ nh hàm l ng c a các anion vô c Clị ượ ủ ơ -, NO2-, NO3-, PO43-, SO42- và cation vô
c Naơ+, K+, NH4+, Ca2+, Mg2+. Trong các ion trên các ion NO3-, SO42- và NH4+ có t m quanầ
tr ng đ c bi t vì nó liên quan tr c ti p đ n các acid cũng nh ph n ng c a các acid v iọ ặ ệ ự ế ế ư ả ứ ủ ớ
NH3 trong khí quy n. Ion Naể+ đ c cho là xu t hi n ch y u t mu i bi n nên đ cượ ấ ệ ủ ế ừ ố ể ượ
dùng đ đánh giá s đóng góp c a h i bi n vào thành ph n m a.ể ự ủ ơ ể ầ ư
Đ ki m tra đ tin c y c a phép phân tích ng i ta xác đ nh cân b ng ion và cânể ể ộ ậ ủ ườ ị ằ
b ng đ d n. V nguyên t c t ng n ng đ anion ph i b ng t ng n ng đ canion trongằ ộ ẫ ề ắ ổ ồ ộ ả ằ ổ ồ ộ
đó t ng n ng đ các ion đ c tính b ng đ n v đ ng l ng/l (eq/l).ổ ồ ộ ượ ằ ơ ị ươ ượ

V i đ d n đi n riêng thì đ d n đi n riêng đo đ c ph i b ng đ d n đi nớ ộ ẫ ệ ộ ẫ ệ ượ ả ằ ộ ẫ ệ
riêng tính t n ng đ các ion d n đi n.ừ ồ ộ ẫ ệ
=
=
Trong đó là đ d n đi n đ ng l ng c c đ i c a ion i.ộ ẫ ệ ươ ượ ự ạ ủ
V i m i chu i thí nghi m c n d ng đ th ph thu cớ ỗ ỗ ệ ầ ự ồ ị ụ ộ
và = r i tìm h s góc c a ph ng trình h iồ ệ ố ủ ươ ồ
qui. N u h s góc n m trong kho ng 0.8 đ n 1.2 thì coi nh k t qu phân tích ch pế ệ ố ằ ả ế ư ế ả ấ
nh n đ c. Nh ng đi m n m quá xa đ ng h i qui ch p nh n đ c là nh ng đi mậ ượ ữ ể ằ ườ ồ ấ ậ ượ ữ ể
nghi v n. N u h s góc n m ngoài kho ng 0.8 đ n 1.2 thì s li u có v n đ . Nguyênấ ế ệ ố ằ ả ế ố ệ ấ ề
nhân có th là có ion nào đó ch a đ c đ nh chu n hay k t qu phân tích không tin c yể ư ượ ị ẩ ế ả ậ
II. TH C NGHI MỰ Ệ
Đ có đ c s m u m a đáng k thì ph i t n r t nhi u công s c và th i gian, đ ngể ượ ố ẫ ư ể ả ố ấ ề ứ ờ ồ
th i ph i ti n hành phân tích m u b ng s c kí ion r t t n kém nên trong bài th c nghi mờ ả ế ẫ ằ ắ ấ ố ự ệ
này đ i t ng nghiên c u m a acid nhân t oố ượ ứ ư ạ
Chu n b chu i 20 m u m a acid nhân t o t các dung d ch chu n c a các ch t thànhẩ ị ỗ ẫ ư ạ ừ ị ẩ ủ ấ
ph n. Đo đ d n đi n riêng và pH c a các m u n c m a r i ki m tra cân b ng ionầ ộ ẫ ệ ủ ẫ ướ ư ồ ể ằ
T cân b ng ion đ a ra k t lu n v đ tin c y c a thí nghi m đã ti n hành.ừ ằ ư ế ậ ề ộ ậ ủ ệ ế
Th tích dung d ch chu n thành ph n c n l y đ pha m u m a acid đ c tính nhể ị ẩ ầ ầ ấ ể ẫ ư ượ ư
sau:
Trong đó Vi là th tích dung d ch thành ph n c n l y, Vể ị ầ ầ ấ m aư là th tích dung d ch m aể ị ư
acid nhân t o c n pha, Cạ ầ i/m aư là n ng đ ch t i trong m a acid nhân t o, Cồ ộ ấ ư ạ i là n ng đồ ộ
dung d ch chu n c a ch t i.ị ẩ ủ ấ

1. D ng c và hóa ch tụ ụ ấ
D ng cụ ụ Hóa ch tấ
Máy đo đ d nộ ẫ
Bình đ nh m c 250mlị ứ
Bình đ nh m c 100mlị ứ
Beaker 250ml
Beaker 50ml
Erlen 250ml
Bình tia
Pipete, B đi u nhi tể ề ệ
KCl 0.01M
NaCl 0.01M
CaCl2 0.01M
(NH4)2SO4 0.01M
NH4Cl 0.01M
MgCl2 0.01M
H2SO4 0.01M
HNO3 0.01M
2. Ti n hành ế
2.1 Pha dung d ch các ch t có n ng đ 0.01M trong bình đ nh m c 50mlị ấ ồ ộ ị ứ
- KCl : m = 0.01 x 0.05 x 74.5 = 0.0373 g
- NaCl : m = 0.01x 0.05 x 58.5 = 0.0293 g
- CaCl2: m = 0.01x 0.05 x 111 = 0.0555g
- (NH4)2SO4: m = 0.01x 0.05 x 132.1 = 0.066 g
- NH4Cl: m = 0.01x 0.05 x 53.49 = 0.0268 g
- MgCl2: m = 0.01x 0.05 x 203.3 = 0.102 g
- H2SO4 : CM = (10d x C%)/M = (10 x 1.84 x 98)/98 = 18.4M

Vdd = (0.01 x 50)/18.4 = 0.0272ml
- HNO3 : CM = (10d x C%)/M = (10 x 1.5 x 63)/63 = 15M
Vdd = (0.01 x 50)/15 = 0.0033ml
2.1 Pha m i 100 ml n c m a acid v i n ng đ các ch t sau đâyỗ ướ ư ớ ồ ộ ấ
STT N ng đ μeq/lồ ộ
Dung
d chị
H2SO4HNO3NH4Cl (NH4)2SO4K2SO4NaCl CaCl2MgCl2
1 500 200 100 1500 200 200 200 100
2 800 100 100 1000 100 100 100 50
3 200 200 200 1600 100 200 100 50
4 100 200 50 800 50 300 200 50
5 300 150 150 1500 800 200 100 20
6 500 200 400 1000 200 200 400 100
7 800 100 100 700 100 100 300 50
8 200 200 200 600 100 200 200 100
9 100 200 500 1200 200 300 200 50
10 300 150 150 500 200 200 100 50
11 500 200 400 500 100 200 400 100
12 800 100 100 600 100 100 300 50
13 200 200 200 600 100 200 200 100
14 1000 200 600 200 200 300 200 50
15 100 150 150 500 200 200 100 50
16 800 500 400 500 200 200 400 100
17 200 400 100 600 100 100 300 50
18 1200 200 200 600 100 200 200 100
19 1000 300 600 200 100 300 200 50
20 300 250 150 500 200 200 100 50
- Đ c c m a ra c c 50 ml và đ nh nhi t 30 phút tr c khi đoổ ố ư ố ổ ị ệ ướ
3. K t qu , th o lu n ế ả ả ậ
- Đ d n c a n c c t quá th p nên không đo đ c đ d nộ ẫ ủ ướ ấ ấ ượ ộ ẫ
- K t qu pH, đ d n, nhi t đ c a 20 m u n c m a acid nhân t o ế ả ộ ẫ ệ ộ ủ ẫ ướ ư ạ
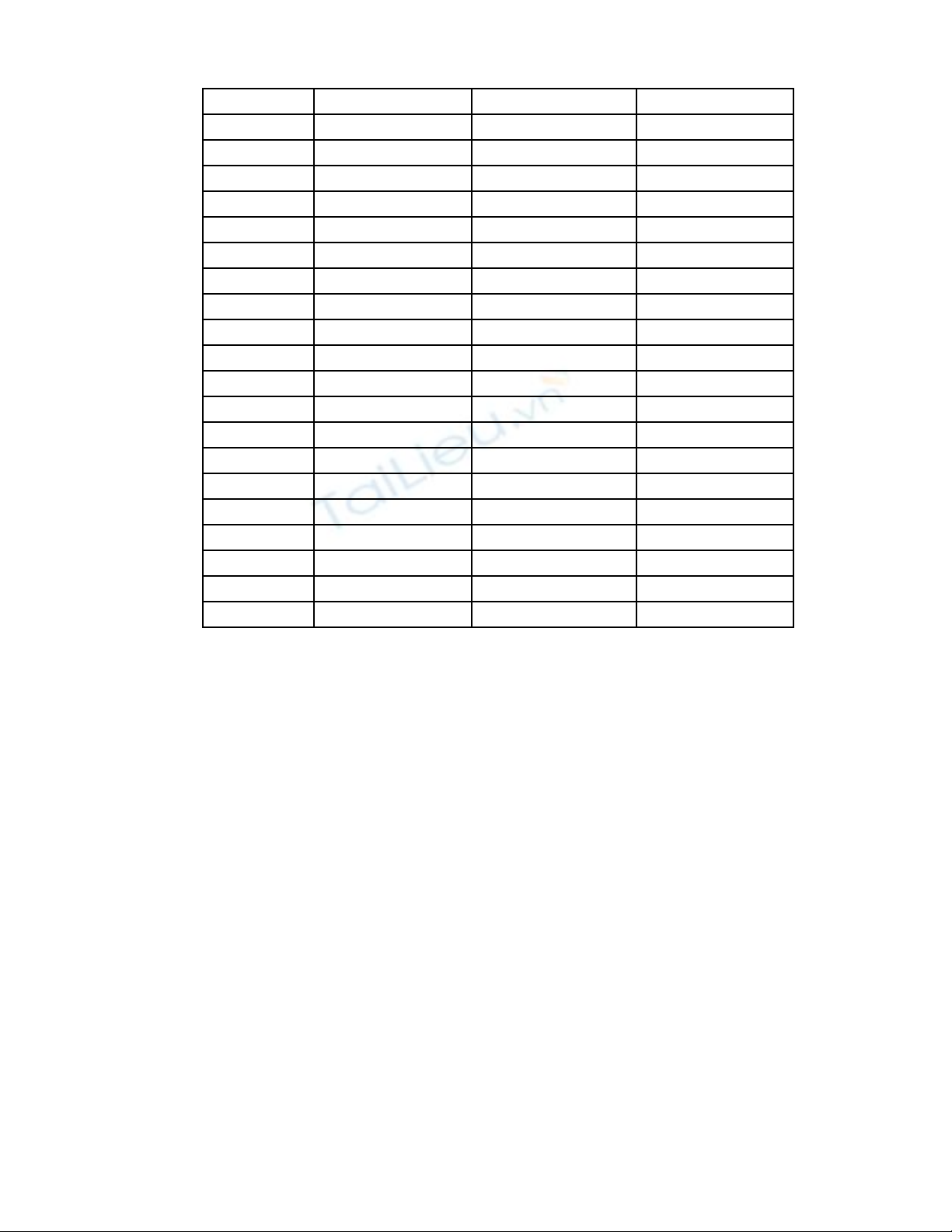
M uẫpH Đ d n (ms)ộ ẫ Nhi t đ (ệ ộ oC)
1 3.3 0.35 28.5
2 4.1 0.42 28.2
3 4.8 0.21 28.4
4 5.1 0.11 28.1
5 4.8 0.25 28
6 4.6 0.34 27.9
7 4.6 0.42 27.6
8 4.9 0.16 27.2
9 4.8 0.15 27.7
10 4.7 0.18 26.6
11 4.6 0.31 26.6
12 4.4 0.41 26.7
13 4.7 0.14 26.7
14 4.3 0.52 26.5
15 5.4 0.09 26.1
16 4.6 0.49 26.7
17 4.8 0.19 26.7
18 4.3 0.61 26.8
19 4.6 0.5 26.2
20 4.7 0.2 26.2
- Ki m tra đ tin c y c a th c nghi mể ộ ậ ủ ự ệ
- H2SO4 → 2H+ + SO4-
1mol 2mol 2mol
- HNO3 → H+ + NO3-
1mol 1mol + 1mol
T ng n ng đ [Hổồộ+] = [H+]/H2SO4 + [H+]/HNO3
pH = -log[H+]
-Ví d m u s 1:ụ ẫ ố





![Bài tập so sánh hơn và so sánh nhất của tính từ [kèm đáp án/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250808/nhatlinhluong27@gmail.com/135x160/77671754900604.jpg)
![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)




![Tài liệu Lý thuyết và Bài tập Tiếng Anh lớp 6 [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250802/hoihoangdang@gmail.com/135x160/18041754292798.jpg)




