Chuyên đ b i d ng HSG Hóaề ồ ưỡ Nguy n Đình Hànhễ
Email: Dhanhcs09@yahoo.com.vn
TOÁN V Đ TAN VÀ TINH TH HYĐRATỀ Ộ Ể
I- KI N TH C C B NẾ Ứ Ơ Ả :
1)Công th c toánứ:
ct
H O
2
m
S 100
m
=
( gam/ 100g H2O)
C%
S 100
100 C%
=
−
( C% là n ng đ % c a dung d ch bão hòa)ồ ộ ủ ị
S
C% 100%
100 S
=
+
( C% là n ng đ % c a dung d ch bão hòa)ồ ộ ủ ị
2) Bài toán xác đ nh l ng k t tinhị ượ ế .
* Khi làm l nh m t dung d ch bão hòa ch t tan r n thì đ tan th ng gi m xu ng, vì v y có m t ph nạ ộ ị ấ ắ ộ ườ ả ố ậ ộ ầ
ch t r n không tan b tách ra ( g i là ph n k t tinh):ấ ắ ị ọ ầ ế
+ N u ch t k t tinh không ng m n c thì l ng n c trong hai dung d ch bão hòa b ng nhau.ế ấ ế ậ ướ ươ ướ ị ằ
+ N u ch t r n k t tinh có ng m n c thì l ng n c trong dung d ch sau ít h n trong dung d ch banế ấ ắ ế ậ ướ ượ ướ ị ơ ị
đ u:ầ
H O
H O
22
m ( sau) m ( H O
2
dd dd bñ) - m (KT) =
* Các b c gi i toán:ướ ả
TH1: ch t k t tinh không ng m n cấ ế ậ ướ TH 2: ch t k t tinh ng m n cấ ế ậ ướ
B1: Xác đ nh ị
ct
m
và
H O
2
m
có trong ddbh tở0 cao.
B2: Xác đ nh ị
ct
m
có trong ddbh tở0 th p ( l ngấ ượ
n c không đ i)ướ ổ
ct H O
2
S
m m
100
=
B3: Xác đ nh l ng ch t k t tinh:ị ượ ấ ế
ct ct
KT
m m (nh ) m ( )ieät ñoä cao nhieät ñoä thaáp= −
B1: Xác đ nh ị
ct
m
và
H O
2
m
có trong ddbh tở0 cao.
B2: Đ t s mol c a hiđrat b k t tinh là a (mol)ặ ố ủ ị ế
⇒
ct
m (KT) H O
2
vaø m (KT)
B3: L p ph ng trình bi u di n đ tan c a dungậ ươ ể ễ ộ ủ
d ch sau ( theo n a)ị ẩ
ct
2
H O
2
m
S 100
m
∆
=
∆
B4: Gi i ph ng trình và k t lu n.ả ươ ế ậ
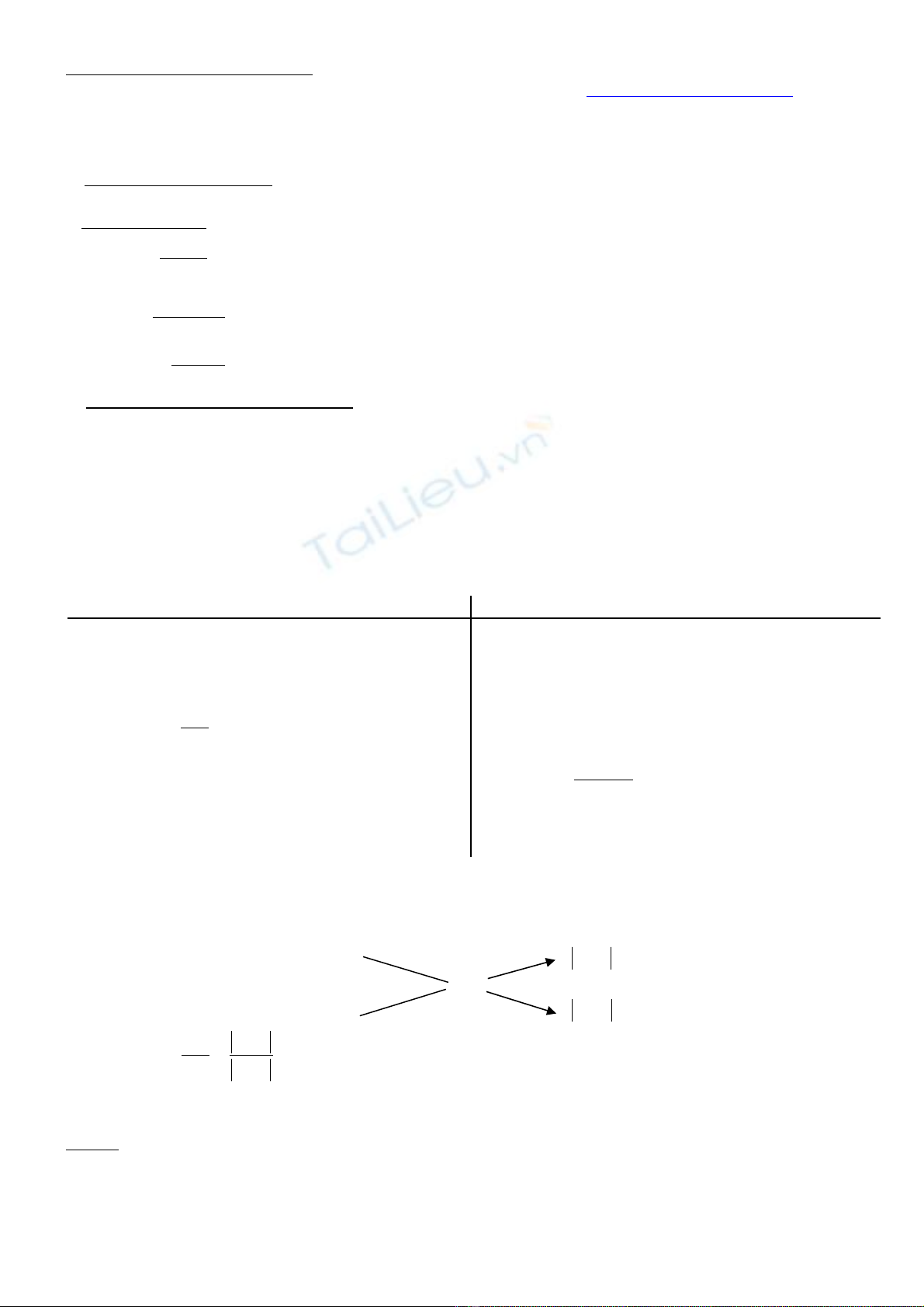
* Ph ng pháp gi i thông minh:ươ ả
Có th gi i đ c các bài toán xác đ nh d ng k t tinh b ng ph ng pháp đ ng chéo. Mu n làmể ả ượ ị ượ ế ằ ươ ườ ố
đ c đi u này chúng ta ph i đ t gi thi t ng c.ượ ề ả ặ ả ế ượ
R n (KT)ắm1C% = x
z y−
z %
ddbh sau m2C% = y
x z−
Suy ra ta có :
mz y
1
m x z
2
−
=−
N u bi t kh i l ng dung d ch ban đ u thì ta hoàn toàn tính đ c kh i l ng ch t r n k t tinh ( dùế ế ố ượ ị ầ ượ ố ượ ấ ắ ế
ch t này có ng m n c hay không ng m n c) ấ ậ ướ ậ ướ
Chú ý:
Mu n xác đ nh k t t a (c a ch t ít tan) có t n t i hay không thì c n xét n ng đ c a dungố ị ế ủ ủ ấ ồ ạ ầ ồ ộ ủ
d ch thu đ c đã đ n n ng đ bão hòa hay ch a. N u ch a thì k t t a không t n t i, ng c l i thì k tị ượ ế ồ ộ ư ế ư ế ủ ồ ạ ượ ạ ế
t a t n t i.ủ ồ ạ
1

Chuyên đ b i d ng HSG Hóaề ồ ưỡ Nguy n Đình Hànhễ
Email: Dhanhcs09@yahoo.com.vn
II- BÀI T P ÁP D NG:Ậ Ụ
1) Làm l nh 600g ddbh NaCl t 90ạ ừ 0C → 100C thì có bao nhiêu gam tinh th NaCl tách ra. Bi t đ tanể ế ộ
c a NaCl 90ủ ở 0C và 100C l n l t là : 50gam ; 35 gam.ầ ượ
H ng d n :ướ ẫ
* 90Ở0C có T = 50 gam nên ta có : 100gam H2O + 50g NaCl → 150g ddbh
? ? 600g
⇒
NaCl
600 50
m (tan) 200g
150
= =
⇒
2
H O
m ( ) 600 200 400gdung moâi = − =
( không đ i)ổ
* 10Ở0C có T = 35 g nên ta có : 100 gam H2O hoà tan đ c 35 g NaClượ
400g → ?
⇒
NaCl
400 35
m (tan) 140g
100
= =
Kh i l ng NaCl k t tinh :ố ượ ế 200 – 140 = 60 gam
2) Đ tan c a CuSOộ ủ 4 85ở0C và 120C l n l t là 87,7g và 35,5g . Khi làm l nh 1887 gam dung d ch bãoầ ượ ạ ị
hoà CuSO4 t 80ừ0C → 120C thì có bao nhiêu gam tinh th CuSOể4.5H2O tách ra kh i dung d ch.ỏ ị
H ng d n :ướ ẫ L u ý vì ch t k t tinh ng m n c nên l ng n c trong dung d ch thay đ iư ấ ế ậ ướ ượ ướ ị ổ
85Ở0C ,
4
CuSO
T=
87,7 gam ⇒ 187,7 gam ddbh có 87,7 gam CuSO4 + 100g H2O
1887g ---------------→ 887gam CuSO4 + 1000g H2O
G i x là s mol CuSOọ ố 4.5H2O tách ra
⇒ kh i l ng Hố ượ 2O tách ra : 90x (g)
Kh i l ng CuSOố ượ 4 tách ra : 160x( gam)
12Ở0C,
4
CuSO
T=
35,5 nên ta có ph ng trình : ươ
887 160x 35,5
1000 90x 100
−=
−
gi i ra x = 4,08 molả
Kh i l ng CuSOố ượ 4 .5H2O k t tinh : 250 ế× 4,08 =1020 gam
3) Cho 0,2 mol CuO tan hoàn toàn trong H2SO4 20% đun nóng, sau đó làm ngu i dung d ch đ n 10ộ ị ế 0C.
Tính kh i l ng tinh th CuSOố ượ ể 4. 5H2O đã tách ra kh i dung d ch, bi t r ng đ tan c a CuSOỏ ị ế ằ ộ ủ 4 10ở0C là
14,4 gam/100g H2O. ( ĐS: 30,7 gam )
H ng d n :ướ ẫ
CuO + H2SO4 → CuSO4 + H2O
0,2 0,2 0,2 0,2 ( mol)
Kh i l ng ddHố ượ 2SO4 :
0, 2 98 100%
20
� �
= 98g
Kh i l ng CuSOố ượ 4 t o ra : 0,2ạ× 160 = 32 gam
G i x là s mol CuSOọ ố 4.5H2O tách ra ⇒ mdd (sau p )ư = (0,2× 80) + 98 – 250x ( gam)
Vì đ tan c a CuSOộ ủ 4 10ở0C là T = 14,4 gam , nên ta có :
32 160x 14, 4
112 250x 114, 4
−=
−
gi i ra x = 0,1228 mol ả⇒
CuSO .5H O
4 2
m (KT) 30, 7=
gam
4) Có 600 gam dung d ch KClOị3 bão hoà ( 200C) n ng đ 6,5% cho bay b t h i n c sau đó l i giồ ộ ớ ơ ướ ạ ữ
h n h p 20ỗ ợ ở 0C ta đ c m t h n h p có kh i l ng chung là 413gam. ượ ộ ỗ ợ ố ượ
a) Tính kh i l ng ch t r n k t tinhố ượ ấ ắ ế
b) Tính kh i l ng n c và kh i l ng KClOố ượ ướ ố ượ 3 trong dung d ch còn l i.ị ạ
H ng d nướ ẫ : làm bay h i b t n c m t dung d ch bão hoà và đ a v nhi t đ ban đ u thì luôn cóơ ớ ướ ộ ị ư ề ệ ộ ầ
xu t hi n ch t r n k t tinhấ ệ ấ ắ ế
Đ t kh i l ng r n KT là : x(g) , g i l ng dung d ch sau khi bay h i là : y(g)ặ ố ượ ắ ọ ượ ị ơ
⇒ h pt : ệ
x y 413
6,5y
x 39
100
+ =
+ =
gi i h ph ng trình tìm đ c x= 13 và y =400ả ệ ươ ượ
2

Chuyên đ b i d ng HSG Hóaề ồ ưỡ Nguy n Đình Hànhễ
Email: Dhanhcs09@yahoo.com.vn
Bài t p t ng tậ ươ ự:
5) Có 540 g ddbh AgNO3 10ở0C, đun nóng dd đ n 60ế0C thì ph i thêm bao nhiêu gam AgNOả3 đ đ tể ạ
b o hoà. Bi t đ tan AgNOả ế ộ 3 10ở0C và 600C l n l t là 170g và 525gam.ầ ượ
6 Xác đ nh l ng k t tinh MgSOị ượ ế 4.6H2O khi làm l nh 1642g ddbh t 80ạ ừ 0C xu ng 20ố0C. Bi t đ tan c aế ộ ủ
MgSO4 là 64,2 g ( 800C) và 44,5g (200C).
7) Cho bi t n ng đ dd bão hòa KAl(SOế ồ ộ 4)2 20ở0C là 5,56%
a) Tính đ tan c a KAl(SOộ ủ 4)2 20ở0C
b) L y m gam dung d ch bão hoà KAl(SOấ ị 4)2 .12H2O 20ở0C đ đun nóng bay h i 200g n c, ph n cònể ơ ướ ầ
l i làm l nh đ n 20ạ ạ ế 0C . Tính kh i l ng tinh th phèn KAl(SOố ượ ể 4)2 .12H2O k t tinh.ế
8) Cho bi t đ tan c a CaSOế ộ ủ 4 là 0,2 gam/100g n c nhi t đ 20ướ ở ệ ộ 0C và kh i l ng riêng c a dungố ượ ủ
d ch bão hoà CaSOị4 20ở0C là D =1g/ml. N u tr n 50ml dung d ch CaClế ộ ị 2 0,012M v i 150ml dung d chớ ị
Na2SO4 0,04M ( 20ở0C) thì có k t t a xu t hi n hay không ?ế ủ ấ ệ
H ng d n :ướ ẫ tính n ng đ c a CaSOồ ộ ủ 4 trong dung d ch thu đ c, n u bé h n n ng đ bão hoà thìị ượ ế ơ ồ ộ
không có k t t a ( và ng c l i)ế ủ ượ ạ . K t qu : không có k t t a.ế ả ế ủ
9) 12Ở0C có 1335gam dung d ch bão hoà CuSOị4 . Đun nóng dung d ch lên đ n 90ị ế 0C. H i ph i thêmỏ ả
vào dung d ch bao nhiêu gam CuSOị4 n a đ đ c dung d ch bão hoà nhi t đ này.ữ ể ượ ị ở ệ ộ
Bi t đ tan CuSOế ộ 4 12ở0C và 900C l n l t là 33,5g và 80gầ ượ
(ĐS: 465gam CuSO4 )
10) Thêm d n dung d ch KOH 33,6% vào 40,3ml dung d ch HNOẫ ị ị 3 37,8% ( D = 1,24 g/ml) đ n khi trungế
hoà hoàn toàn thì thu đ c dung d ch A. Đ a dung d ch A v 0ượ ị ư ị ề 0C thì đ c dung d ch B có n ng đượ ị ồ ộ
11,6% và kh i l ng mu i tách ra là m (gam). Hãy tính m và cho bi t dung d ch B đã bão hoà ch a ? vìố ượ ố ế ị ư
sao ?
ĐS: m = 21,15 gam , dung d ch đã bão hoà vì có m ( gam ) mu i không tan thêm đ c n aị ố ượ ữ
----------------------------------
Trên đây ch là m t ph n nh trong t li u c a tôi ! Tôi còn nhi u t li u khác:ỉ ộ ầ ỏ ư ệ ủ ề ư ệ
9 ch đ BT đ nh tính b i d ng HSG l p 9ủ ề ị ồ ưỡ ớ
Lý thuy t Hóa h c THCS căn b n và nâng caoế ọ ả
25 ch đ BT đ nh l ng b i d ng HSG l p 9ủ ề ị ượ ồ ưỡ ớ
Giáo án đi n t : Hóa 8, Hóa 9ệ ử
Tuy n t p các đ thi HSG hóa 9 và chuyên hóa 10 các t nh và thành phể ậ ề ỉ ố
Giáo án Word : Hóa 8, Hóa 9 đ y đ và so n r t chi ti t.ầ ủ ạ ấ ế
Sáng ki n kinh nghi m : v ph ng pháp d y h c; b i d ng HSG ; ph ng pháp v nế ệ ề ươ ạ ọ ồ ưỡ ươ ậ
d ng sáng t o quy t c đ ng chéo đ gi i các bài toán pha tr n có x y ra ph n ng.ụ ạ ắ ườ ể ả ộ ả ả ứ
Tài li u b i d ng GV d y Hóa THCS ( c a B GD&ĐT)ệ ồ ưỡ ạ ủ ộ
Các Files đ ng v ho t đ ng lò cao, s n xu t vôi …ộ ề ạ ộ ả ấ
B đ ki m tra t 15 phút tr lên ( ngu n TLBDTX)ộ ề ể ừ ở ồ
Các b n liên l c v i tôi qua đ a ch ạ ạ ớ ị ỉ Email: Dhanhcs09@yahoo.com.vn đ có đ c m t trong các tàiể ượ ộ
li u trên. Xin thông c m vì các tài li u này ch a đ a vào th vi n violet.ệ ả ệ ư ư ư ệ
3





![Bài tập so sánh hơn và so sánh nhất của tính từ [kèm đáp án/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250808/nhatlinhluong27@gmail.com/135x160/77671754900604.jpg)
![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)




![Tài liệu Lý thuyết và Bài tập Tiếng Anh lớp 6 [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250802/hoihoangdang@gmail.com/135x160/18041754292798.jpg)




