
BÀI TẬP HOÁ HỌC VÔ CƠ TRONG
NHỮNG KÌ THI OLYMPIC HÓA HỌC
Chúng tôi s u t m và biên so n tài li u này t tuy n t p các đ thi olympic hoá h c đã t ng đ c gi i thi uư ầ ạ ệ ừ ể ậ ề ọ ừ ượ ớ ệ
trong hai năm tr l i đây di n đàn OlympaVN. Hi v ng r ng s m t ph n nào đó giúp cho các b n h c sinh thamở ạ ở ễ ọ ằ ẽ ộ ầ ạ ọ
gia kì thi ch n h c sinh gi i Hoá h c qu c gia l n th 15 (2009) s p t i đây s có thêm tài li u ôn t p, giúp các b nọ ọ ỏ ọ ố ầ ứ ắ ớ ẽ ệ ậ ạ
có đ c s chu n b t t h n. C m n các b n tr r t nhi u vì nh ng đóng góp cho forum su t th i gian qua, chúcượ ự ẩ ị ố ơ ả ơ ạ ẻ ấ ề ữ ố ờ
cho các b n thi th t t t. Chemistry: Art, Science and Fun! ạ ậ ố (Youngchemist, Nov
2008)
Bài 1 (Kim lo i ki m) ạ ề
M t m u oxit kim lo i ki m đ c hoà tan trong dung d ch n c c a m t axit hiđrohalogenua đãộ ẫ ạ ề ượ ị ướ ủ ộ
bi t. Dung d ch thu đ c ch có halogenua kim lo i t ng ng. Ph n kh i l ng ch t tan trongế ị ượ ỉ ạ ươ ứ ầ ố ượ ấ
dung d ch sau ph n ng b ng ph n kh i l ng c a hydrohalogenua trong dung d ch đ u. ị ả ứ ằ ầ ố ượ ủ ị ầ
a) Cho bi t m i quan h đ nh l ng gi a ph n kh i l ng c a mu i trong dung d ch trungế ố ệ ị ượ ữ ầ ố ượ ủ ố ị
hòa sau ph n ng và kh i l ng phân t c a kim lo i ki m? Đ a ra công th c liên h .ả ứ ố ượ ử ủ ạ ề ư ứ ệ
b) T công th c này hãy xác đ nh oxit kim lo i nào đã hoà tan trong axit nào. ừ ứ ị ạ
Đáp án:
a) Ph n kh i l ng c a mu i trong dung d ch sau cùng đ c cho b i công th cầ ố ượ ủ ố ị ượ ở ứ
8M
1M
m+
−
=
v i m là kh i l ng phân t kim lo i ki m. ớ ố ượ ử ạ ề
b) Đi t trên xu ng d i trong b ng tu n hoàn ta nh n đ c các giá tr : ừ ố ướ ả ầ ậ ượ ị
- m(Li)=0,40
- m(Na)=0,71
- m(K)=0,81
- m(Rb)=0,90
- m(Cs)=0,94
Ph n kh i l ng c a axit hydrohalogenua ch có giá tr th c trong tr ng h p th nh t.ầ ố ượ ủ ỉ ị ự ườ ợ ứ ấ
V y kim lo i là liti, còn axit đ c s d ng là axit b t kỳ trong s ba axit: HCl, HBr, HI.ậ ạ ượ ử ụ ấ ố
Không dùng HF do LiF khó tan.
1
inorganic chemistry
Forum
Olym piavn
N ov, 2008

Bài 2 (Kim lo i chuy n ti p) ạ ể ế
Zirconi, m t kim lo i màu tr ng b c, có ánh kimộ ạ ắ ạ
sáng. Là m t h p ph n không th thay th trong cácộ ợ ầ ể ế
h p kim s d ng trong công nghi p h t nhân v iợ ử ụ ệ ạ ớ
nhi m v c a nó là xây d ng các lò ph n ng h tệ ụ ủ ự ả ứ ạ
nhân. M t trong s ngu n cung c p zirconi ch y uộ ố ồ ấ ủ ế
là khoáng zircon (49,76% zirconi và 15,32% silic).
Kim lo i Zirconi đ c s n xu t ch y u b ngạ ượ ả ấ ủ ế ằ
ph ng pháp Kroll và m t s ph ng pháp khác. ươ ộ ố ươ
Trong ph ng pháp Kroll thì m t h n h p c a zircon và than c c đ c x lý v i clo 1000ươ ộ ỗ ợ ủ ố ượ ử ớ ở oC
và s n ph m zirconi tetraclorua sinh ra đ c kh b i magie cho zirconi kim lo i d ng b tả ẩ ượ ử ở ạ ở ạ ọ
x p. D ng b t x p này đ c tinh ch , làm nóng ch y b ng h quang và hình thành d ngố ạ ọ ố ượ ế ả ằ ồ ở ạ
th i. ỏ
a) Xác đ nh công th c hoá h c c a khoáng zircon.ị ứ ọ ủ
b) Vi t các ph n ng đi u ch zirconi trong quá trình Kroll.ế ả ứ ề ế
c) Có bao nhiêu t n zirconi nh n đ c khi s d ng 32,5 t n qu ng zircon ch a 12,4% t pấ ậ ượ ử ụ ấ ặ ứ ạ
ch t tr . Cho r ng hi u su t c a toàn quá trình ch đ t 95,5% v kh i l ng.ấ ơ ằ ệ ấ ủ ỉ ạ ề ố ượ
d) B t x p zirconi luôn ch a m t kim lo i khác r t khó tách ra. Hãy cho bi t đó là kim lo iọ ố ứ ộ ạ ấ ế ạ
nào và t i sao nó l i xu t hi n trong b t x p. ạ ạ ấ ệ ọ ố
Đáp án:
a) Công th c hoá h c c a khoáng zircon là ZrSiOứ ọ ủ 4.
b) Các ph n ng x y ra trong quá trình đi u ch Zr kim lo i. ả ứ ả ề ế ạ
ZrSiO4 + 4C + 4Cl2 = ZrCl4 + SiCl4 + 4CO
ZrSiO4 + 2C + 2Cl2 = ZrCl4 + SiO2 + CO
ZrCl4 + 2Mg = Zr + 2MgCl2
c) m = 13,52 (t n) zirconi. ấ
d) Zirconi luôn đi cùng v i Hafni (Hf). Khó có th phân bi t đ c hai kim lo i này do tínhớ ể ệ ượ ạ
ch t hóa h c c a chúng gi ng h t nhau. ấ ọ ủ ố ệ
2
Bài 3 (Kim lo i chuy n ti p)ạ ể ế
M t ch t r n màu tr ng X tham gia m t lo t các thí nghi m trong đó X b đ t thành tro d i tácộ ấ ắ ắ ộ ạ ệ ị ố ướ
d ng c a các lu ng khí vào khác nhau. K t q a thí nghi m đ c th ng kê b ng sau:ụ ủ ồ ế ủ ệ ượ ố ở ả
Thí nghi m sệ ố Khí vào S chênh l ch kh i l ng m u so v i ban đ uự ệ ố ượ ẫ ớ ầ
1 N2-37,9
2 NH3-51,7
3 O2-31,0
4 HCl +9,5
5 HCl + Cl2-100,0
Trong t t c các thí nghi m thì trong h n h p sau ph n ng ngoài khí ban đ u còn có m t khíấ ả ệ ỗ ợ ả ứ ầ ộ
ch a bi t Y. thí nghi m s 5 xu t hi n m t h p ch t màu đ nâu Z ng ng t khi ti n hànhư ế Ở ệ ố ấ ệ ộ ợ ấ ỏ ư ụ ế
b c làm l nh trong thí nghi m. ướ ạ ệ
a) S d ng các giá tr cho b ng trên hãy xác đ nh các ch t đ c ký hi u b ng ch cái. ử ụ ị ở ả ị ấ ượ ệ ằ ữ
b) Vi t các ph n ng x y ra trong thí nghi m. ế ả ứ ả ệ
c) Cho bi t c u trúc c a Z trong pha khí. ế ấ ủ
Đáp án:
a) X là FeCO3
Y là CO2
Z là FeCl3
b) Các ph n ng sau đây đã x y raả ứ ả
FeCO3 = FeO + CO2
3FeCO3 + 2NH3 = 3Fe + 3CO2 + 3H2O
4FeCO3 = 2Fe2O3 + 4CO2
FeCO3 + 2HCl = FeCl2 + CO2 + H2O
2FeCO3 + 4HCl + Cl2 = 2FeCl3 + 2CO2 + 2H2O
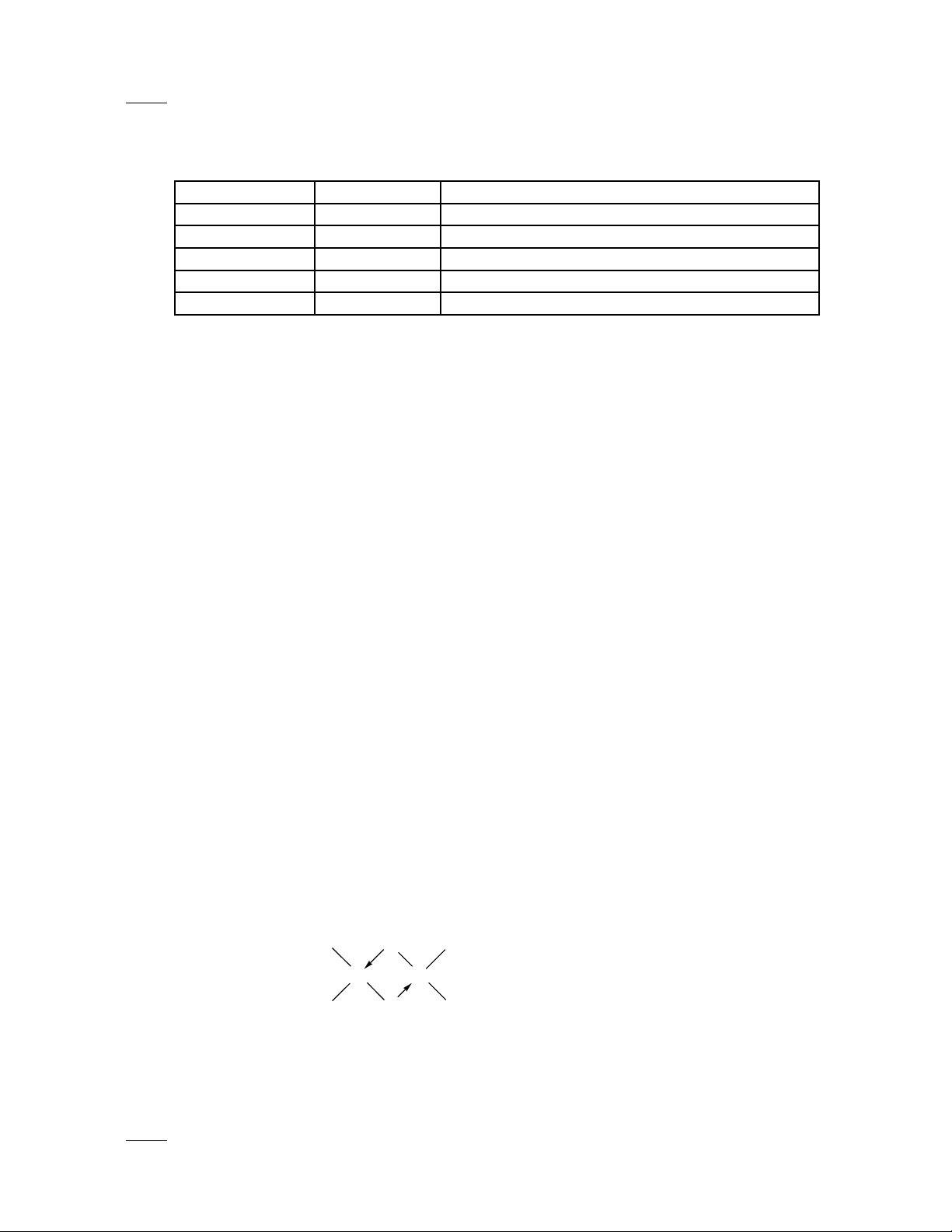
c) pha h i thì s t (III) clorua t n t i d ng dime (FeClỞ ơ ắ ồ ạ ở ạ 3)2
Cl
Fe
Cl
Cl
Fe
Cl
Cl
Cl
Bài 4 (Phi kim)
3
Cho đ n t n th k XIX thì thu c súng đen là v t li u n duy nh t mà loài ng i đ c bi t.ế ậ ế ỷ ố ậ ệ ổ ấ ườ ượ ế
Tr i qua nhi u năm thì thu c súng đen đ c dùng vào m c đích quân s . ả ề ố ượ ụ ự
Ngày nay nó ch y u đ c s d ng trong k thu tủ ế ượ ử ụ ỹ ậ
bi u di n tín hi u (tín hi u tên l a, pháo hoa) cũngể ễ ệ ệ ử
nh làm đ u đ n cho các súng ng n th thao. Thànhư ầ ạ ắ ể
ph n c a thu c súng đen có th r t khác nhau nh ngầ ủ ố ể ấ ư
luôn ch a nh ng thành ph n c b n: diêm tiêu (kaliứ ữ ầ ơ ả
nitrat), l u huỳnh và than. Ti n hành phân tích hóa h cư ế ọ
thu c súng đen cho k t qu là 75% diêm tiêu, 13%ố ế ả
cacbon và 12% l u huỳnh v kh i l ng. ư ề ố ượ
a) Vi t ph n ng th hi n s cháy c a thu c súng đen v i các thành ph n này. Cho bi tế ả ứ ể ệ ự ủ ố ớ ầ ế
vai trò c a t ng lo i nguyên li u.ủ ừ ạ ệ
b) N u nh thành ph n các nguyên li u trong thu c súng đen có thay đ i thì có th thuế ư ầ ệ ố ổ ể
đ c các lo i s n ph m cháy nào? Minh h a b ng ph ng trình hóa h c.ượ ạ ả ẩ ọ ằ ươ ọ
Đáp án:
a) T l thành ph n các nguyên li u là KNO3 : C : S = 0,743 : 1,08 : 0,375 = 2 : 3 : 1ỉ ệ ầ ệ
Đi u này phù h p v i ph n ng: ề ợ ớ ả ứ
2KNO3 + 3C + S = K2S + N2 + 3CO2
KNO3 là ch t oxy hóa, S là ch t bu c (binder) còn C là nguyên li u (ch t kh )ấ ấ ộ ệ ấ ử
b) Các s n ph m khác có th có là: KNOả ẩ ể 2, SO2, K2CO3; K2SO3; K2SO4
4KNO3 + C + S = 4KNO2 + CO2 + SO2
4KNO3 + 2C + 3S = 2K2CO3 + CO2 + N2
2KNO3 + C + S = K2SO4 + CO2 + N2
4KNO3 + 3C + 2S = 2K2SO3 + 3CO2 + 2N2
4

Bài 5 (Kim lo i chuy n ti p) ạ ể ế
Các h p ch t cromợ ấ VI, đ c bi t là các hydroxit đ u là các ch t oxy hóa m nh. Trong các phòngặ ệ ề ấ ạ
thí nghi m Hóa h c thì tính oxy hóa c a nó th ng đ c dùng đ tinh ch các khí có l n Hệ ọ ủ ườ ượ ể ế ẫ 2S.
Khi m t m u khí cacbon dioxit có l n khí hydro sunfua đ c s c qua dung d ch kali dicromatộ ẫ ẫ ượ ụ ị
trong s có m t c a axit sunfuric thì xu t hi n m t k t t a màu vàng không tan và màu c aự ặ ủ ấ ệ ộ ế ủ ủ
dung d ch chuy n sang xanh lá cây. ị ể
a) Vi t công th c hóa h c c a t t c các cromế ứ ọ ủ ấ ả VI hydroxit mà em bi t.ế
b) Vi t ph n ng hóa h c x y ra trong quá trình tinh ch . ế ả ứ ọ ả ế
c) Có th s d ng các ch t oxy hoá t ng t đ tinh ch khí cacbon dioxit đ c không?ể ử ụ ấ ươ ự ể ế ượ
Gi i thích. ả
Đáp án:
a) CrO2(OH)2 (hay H2CrO4), Cr2O5(OH)2 (hay H2Cr2O7) cũng nh các hydroxit khác có côngư
th c chung nCrOứ3.Cr(OH)2.
b) 3H2S + K2Cr2O7 + 4H2SO4 → K2SO4 + Cr2(SO4)3 + 3S + 7H2O
c) X y ra ph n ng sau: 3SOả ả ứ 2 + K2Cr2O7 + H2SO4 → K2SO4 + Cr2(SO4)3 + H2O
5





![Bài tập so sánh hơn và so sánh nhất của tính từ [kèm đáp án/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250808/nhatlinhluong27@gmail.com/135x160/77671754900604.jpg)
![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)




![Tài liệu Lý thuyết và Bài tập Tiếng Anh lớp 6 [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250802/hoihoangdang@gmail.com/135x160/18041754292798.jpg)




