
CHƯƠNG 3 - PHI KIM – SƠ LƯỢC VỀ BẢNG TUẦN HOÀN
CÁC NGUYÊN TỐ HOÁ HỌC
I. Mục tiêu bài học
1.Kiến thức
-Hs nắm được tính chất của phi kim, clo, cacbon, silic, oxit cacbon,
axit cacbonic, tính chất của muối cacbonat.
-Cấu tạo bảng hệ thống tuần hoàn và sự biến đổi tuần hoàn tính chất
của nguyên tố trong chu kỳ, nhóm và ý nghĩa của bảng tuần hoàn.
2.Kỹ năng - Rèn kn lập sơ đồ dãy chuyển đổi các chất, viết ptpư.
- Biết vận dụng bảng tuần hoàn, hoạt động nhóm .
3.Thái độ : Yêu khoa học, ý thức học tập.
II. Phương tiện dạy học :
Gv : hệ thống câu hỏi, bài tập để hướng dẫn học sinh hoạt động, bảng phụ.
III. Hoạt động dạy học :
1. Ổn định lớp : (1')
2. Kiểm tra (5’)
HS1: -Nêu quy luật biến đổi tính chất các nguyên tố trong bảng hệ
thống tuần hoàn? -ý nghĩa của bảng hệ thống tuần hoàn?
HS2: chữa bài tập 6 sgk.
3. Bài mới :

*Gtb :
Hoạt động của thầy và trò Nội dung
*HĐ1(15’) Kiến thức cần nhớ
G: chiếu sơ đồ sau lên màn hình
+ +
(1) (3)
(2) (+)
G: yêu cầu hs điền các loại chất thích
hợp vào ô trống, đồng thời điền các loại
chất thích hợp tác dụng với phi kim.
H: làm bài tập trên
G: chiếu sơ đồ 1 đã hoàn chỉnh lên màn
hình.
G: Chiếu sơ đồ 2 lên màn hình, y/c hs
hoàn chỉnh sơ đồ và viết phương trình
phản ứng minh hoạ.
I.Kiến thức cần nhớ
1.Tính chất hoá học của phi kim.
2.Tính chất hoá học của một phi
kim cụ thể
a/Tính chất hoá học của
clo.
PT:
Phi kim
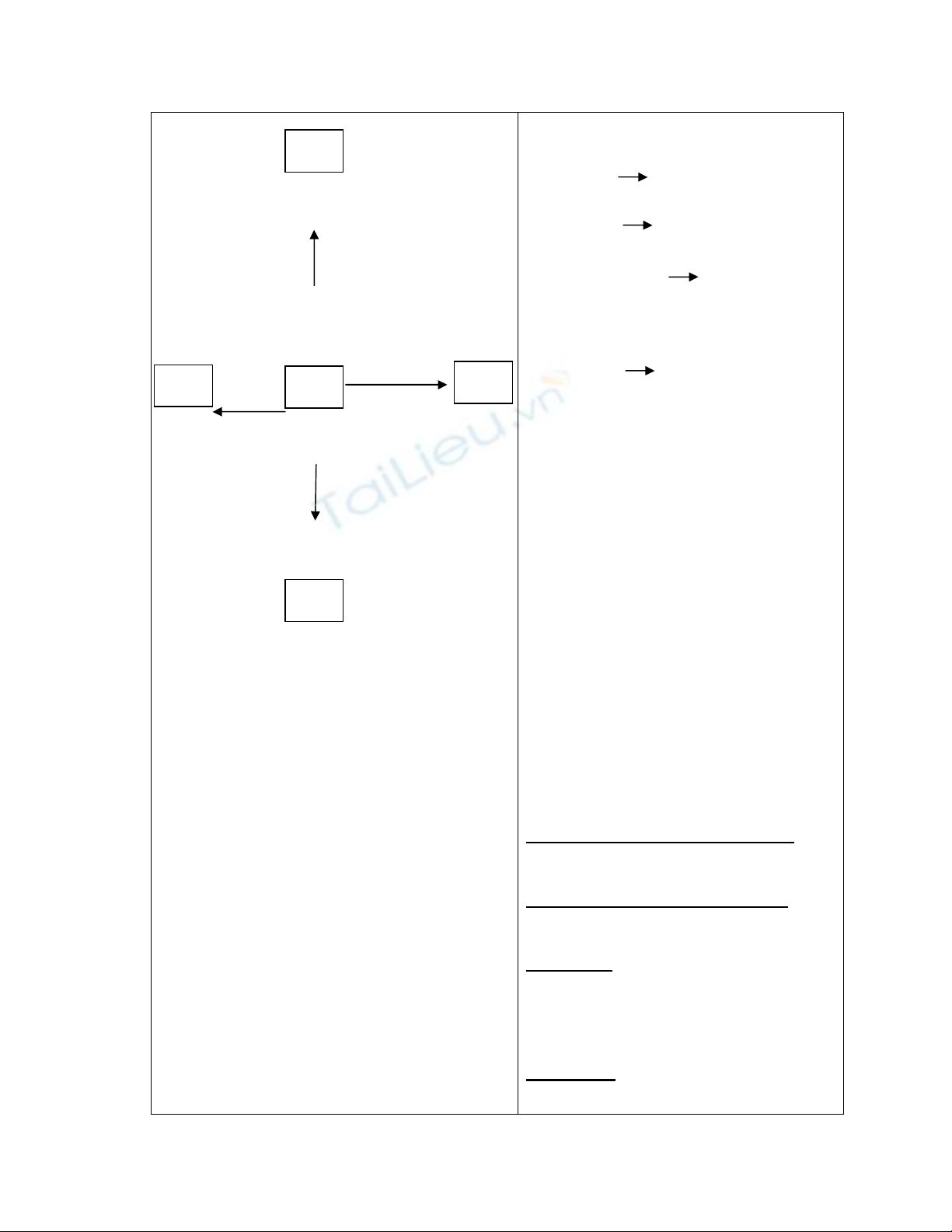
(4) H2O
H2 dd NaOH
(1) (3)
kim loại (2)
H: hoàn thành bài tập của mình
G: chiếu bài làm của một vài hs lên
màn hình và nhận xét.
G: Treo bảng phụ ghi sơ đồ chuyển hoá
chưa đầy đủ y/c hs hoàn thành và viết
ptpư minh hoạ
H: thảo luận nhóm, ghi lại vào vở , giấy
trong( hoặc bảng nhóm)
1.H2 + Cl2 t 2 HCl
2.Mg + Cl2 t MgCl2
3. Cl2 + 2NaOH NaCl
NaClO + H2O
4.H2O + Cl2 HCl + HClO
b.Tính chất hoá học của
cacbon và hợp chất của
cacbon.
II.Bài tập
clo

G: Chiếu sơ đồ 3 đã được điền đầy đủ
lên màn hình.
-Chiếu ptpư của các nhóm viết minh
hoạ và nhận xét.
*HĐ2(25’) bài tập
G: Chiếu đề bài tập 1 lên màn hình ->
gợi ý để hs làm bài tập 1.
Bài tập 1: Trình bày pphh để phân biệt
các chất khí không màu(đựng trong các
bình riêng biệt bị mất nhãn) CO, CO2,
H2
H: Làm bài tập vào vở.
G: gọi hs trình bày bài làm hoặc chiếu
lên màn hình.
G: Y/c hs làm bài tập 2:
Bài tập 2: Cho 10,4 gam hỗn hợp gồm
MgO, MgCO3 hoà tan hoàn toàn trong
dd HCl, toàn bộ khí sinh ra được hấp
thụ hoàn toàn bằng dd Ca(OH)2 dư,
thấy thu được 10 gam kết tủa. Tính khối
Bài tập 1:
-Lần lượt dẫn các khí vào dd nước
vôi trong dư:
+Nếu thấy dd nước vôi trong vẩn
đục là CO2.
Ca(OH)2 + CO2 -> CaCO3+ H2O
+Nếu dd nước vôi trong không vẩn
đục là CO, H2.
-Đốt cháy 2 khí còn lại rồi dẫn sản
phẩm vào nước vôi trong dư:
+Nếu thấy nước vôi trong vẩn đục
thì khí đem đốt là khí CO.
2CO + O2 -> 2CO2
CO2 + Ca(OH)2 -> CaCO3 + H2O
-Còn lại là H2.
2H2 + O2 -> 2H2O
Bài tập 2:
Phương trình:
1)MgO + 2HCl -> MgCl2 + H2O
2)MgCO3 + 2HCl -> MgCl2 + H2O

lượng mỗi chất trong hỗn hợp ban đầu.
G: Gọi HS làm từng phần sau:
-Viết các ptpư
-Tính số mol CaCO3 -> số mol CO2 ở
pư (2).
-Tính khối lượng MgCO3.
-Tính khối lượng MgO.
+ CO2
3) CO2+ Ca(OH)2 -> CaCO3 + H2O
Số mol CaCO3 = 0,1 mol
Số mol CO2 = Số molMgCO3 = 0,1
mol
Khối lượng MgCO3 là:
0,1 x 84 = 8,4 gam
Khối lượng MgO :
10,4 – 8,4 = 2 gam
IV. Luyện tập , củng cố (2’)
Gv hệ thống bài
Hs ghi nhớ , làm bài tập
V. Dặn dò : Làm bài tập 4,5,6 sgk + đọc trước bài: Thực hành





![Bài tập so sánh hơn và so sánh nhất của tính từ [kèm đáp án/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250808/nhatlinhluong27@gmail.com/135x160/77671754900604.jpg)
![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)




![Tài liệu Lý thuyết và Bài tập Tiếng Anh lớp 6 [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250802/hoihoangdang@gmail.com/135x160/18041754292798.jpg)




