
Đ C NG ÔN T P MÔN HOÁ H C 10 Ề ƯƠ Ậ Ọ
CH NG I: NGUYÊN TƯƠ Ử
1/ Thành ph n nguyên tầ ử
* H t nhân : Proton (p) : đi n tích = +1 ; kh i l ng 1uạ ệ ố ượ
N tron (n): đi n tích = 0 ; kh i l ng 1uơ ệ ố ượ
* V nguyên t : ỏ ử Electron (e): đi n tích = -1 ; kh i l ng : 5,5.10ệ ố ượ –4u
2/ H t nhân nguyên t . nguyên t hóa h c, đng vạ ử ố ọ ồ ị
* S đn v đi n tích h t nhân = s proton = s electron = Z.ố ơ ị ệ ạ ố ố
* S Kh i A : A = Z + Nố ố
* S hi u nguyên t = s đn v điên tích h t nhân = Z.ố ệ ử ố ơ ị ạ
* Kí hi u nguyên t : ệ ử
* Các đng v c a cùng m t nguyên t hóa h c là nh ng nguyên t có cùng s proton nh ng ồ ị ủ ộ ố ọ ữ ử ố ư
khác nhau v s n tron, do đó s kh i A c a chúng cũng khác nhau.ề ố ơ ố ố ủ
* Nguyên t kh i trung bình các h n h p đng v :ử ố ỗ ợ ồ ị
Trong đó: A, B là nguyên t kh i c a đng v A, ử ố ủ ồ ị B.
a, b là % s nguyên t c a đng v A và ố ử ủ ồ ị B.
3/ C u trúc l p v e c a nguyên tấ ớ ỏ ủ ử
3.1. Orbital nguyên tử
Lo i AOạHình d ngạ
AO s Hình c uầ
AO p
Hình s 8 n i đc phân b theo các tr c c a h t a đ Descartes (Đ -ố ổ ượ ố ụ ủ ệ ọ ộ ề
các)
AO pX (V trí AO p phân b trên tr c Ox)ị ố ụ
AO py (V trí AO p phân b trên tr c Oy)ị ố ụ
AO pz (V trí AO p phân b trên tr c Oz)ị ố ụ
AO d ,f Có hình d ng ph c t p.ạ ứ ạ
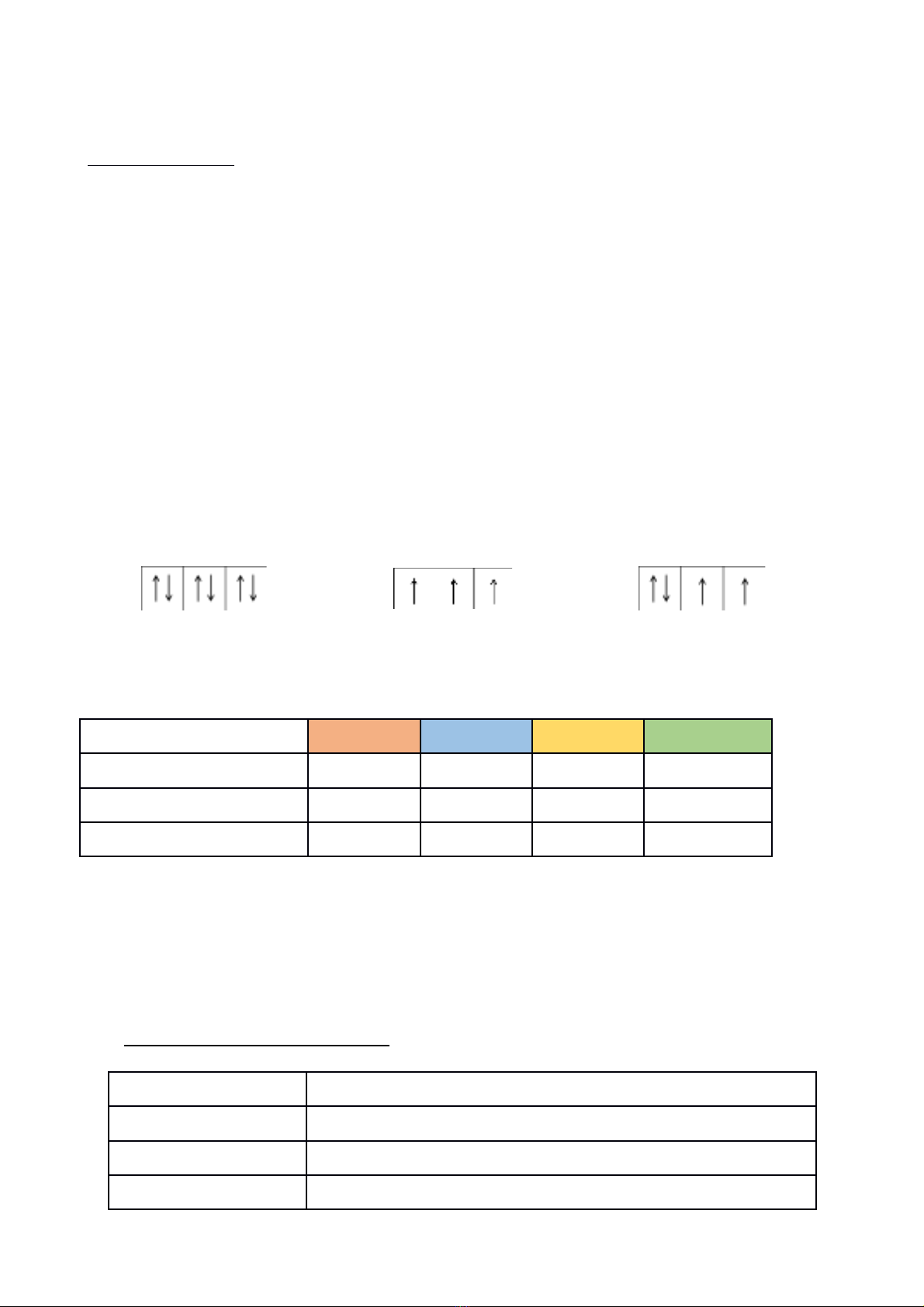
M t AO đc bi u di n b ng m t ô vuông, g i là ô orbital ộ ượ ể ễ ằ ộ ọ
M t AO ch a t i đa 2 electron => 2 electron này g i là c p electron ghép đôi.ộ ứ ố ọ ặ
N u AO ch a 1 electron => 1 electron này g i là electron đc thân.ế ứ ọ ộ
N u AO không ch a electron nào => g i là AO tr ngế ứ ọ ố
3.2. L p và phân l p electronớ ớ
* L p electronớ
- Trong nguyên t , các electron đc s p x p thành t ng l p (kí hi u K, L, M, N, O, P, Q) tử ượ ắ ế ừ ớ ệ ừ
g n đn xa h t nhân, theo th t t l p n = 1 đn n = 7. ầ ế ạ ứ ự ừ ớ ế
- Các electron trên cùng m t l p có năng l ng g n b ng nhauộ ớ ượ ầ ằ .
- L p e càng g n h t nhân có năng l ng càng th p => l p K có năng l ng th p nh t (e ớ ầ ạ ượ ấ ớ ượ ấ ấ ở
l p này b gi ch t nh t).ớ ị ữ ặ ấ
* P hân l p electronớ
- M i l p electron phân chia thành các phân l p, kí hi u b ng các ch cái vi t th ng: s, p, d,ỗ ớ ớ ệ ằ ữ ế ườ
f(theo t t năng l ng: ứ ự ượ s<p<d<f).
- Các electron thu c các phân l p s, p, d và f đc g i t ng ng là các electron s, p, d và f. ộ ớ ượ ọ ươ ứ
- Các electron trên cùng m t phân l p có năng l ng b ng nhauộ ớ ượ ằ .
3.3. C u hình e nguyên tấ ử
* Nguyên lí v ng b n: tr ng thái c b n các e chi m các orbital có m c năng l ng t th pữ ề Ở ạ ơ ả ế ứ ượ ừ ấ
đn cao ế
Th t các m c năng l ng: ứ ự ứ ượ 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d……
* Nguyên lí Pauli: M i orbital ch ch a t i đa 2 electron và có chi u t quay ng c nhauỗ ỉ ứ ố ề ự ượ
* Quy t c Hund (Hun)ắ: Trong cùng m t phân l p ch a bão hoà, các electron s phân b vào cácộ ớ ư ẽ ố
orbital sao cho s electron đc thân là t i đa.ố ộ ố
* S e t i đa trên m i phân l p: số ố ỗ ớ 2, p6,d10, f14phân l p ớbão hòa.
* Phân l p ch a m t n a s electron t i đa: sớ ứ ộ ử ố ố 1, p3,d5, f7 phân l p ớbán bão hòa.
* Phân l p ch a ch a đ s electron t i đa: pớ ứ ư ủ ố ố 4,d7, f10.... phân l p ớch a bão hòaư.
Phân l p bão hòaớPhân l p bán bão hòaớPhân l p ch a bão hòaớ ư
3.4. Xác đnh s AO và s electron t i đa trong m t phân l p và trong m i l pị ố ố ố ộ ớ ỗ ớ
L p (n)ớK(n=1) L (n=2) M(n=3) N(n=4)
S phân l pố ớ 1(1s) 2(2s2p) 3(3s3p3d) 4(4s4p4d4f)
S AO = nố2 (n 4) 1 4 9 16
S e t i đa = 2nố ố 2(n 4) 2 8 18 32
3.5. C u hình electron nguyên t :ấ ử
Cách vi t c u hình electron trong nguyên t :ế ấ ử
+ Xác đnh s electron ị ố
+ Phân b các electron vào phân l p theo th t tăng d n m c năng l ngố ớ ứ ự ầ ứ ượ
+ Vi t electron theo th t các l p và phân l p.ế ứ ự ớ ớ
* Đc đi m l p electron ngoài cùng:ặ ể ớ
Các electron l p ngoài cùng quy t đnh tính ch t hóa h c c a m t nguyên t .ở ớ ế ị ấ ọ ủ ộ ố
S e l p ngoài cùngố ớ Tính ch tấ
1, 2, 3 Kim lo i (tr H, B là phi kim; He là khí hi m)ạ ừ ế
5, 6, 7 Phi kim
8 Khí hi m: b n v ng h u nh không tham gia ph n ng hóaế ề ữ ầ ư ả ứ

học.
4 Kim lo i ho c phi kimạ ặ
CH NG IIƯƠ : B NG TU N HOÀN CÁC NT HÓA H C VÀ ĐNH LU T TU N HOÀNẢ Ầ Ố Ọ Ị Ậ Ầ
1/B ng tu n hoàn các nguyên t hóa h cả ầ ố ọ
1.1) Nguyên t c s p x p: ắ ắ ế
1.2) C u t o b ng tu n hoàn:ấ ạ ả ầ
a- Ô nguyên tố: STT ô nguyên t = Zố
b- Chu k :ỳ Chu k là dãy các nguyên t mà nguyên t c a chúng có cùng s l p electron,ỳ ố ử ủ ố ớ
đc x p theo chi u đi n tích h t nhân tăng d n. ượ ế ề ệ ạ ầ STT chu kì= s l p eố ớ
* Chu k nh : g m chu k 1, 2, 3.ỳ ỏ ồ ỳ
* Chu k l n: g m chu k 4, 5, 6, 7.ỳ ớ ồ ỳ
c- Nhóm nguyên tố: là t p h p các nguyên t mà nguyên t có c u hình electron t ng tậ ợ ố ử ấ ươ ự
nhau , do đó có tính ch t hóa h c g n gi ng nhau và đc x p thành m t c t. ấ ọ ầ ố ượ ế ộ ộ
Nhóm A: nguyên t s và pố
* S th t nhóm = s electron hóa tr = s electron l p ngoài cùng.ố ứ ự ố ị ố ớ
* S bi n đi tu n hoàn v c u hình electron l p ngoài cùng c a nguyên t các nguyên t ự ế ổ ầ ề ấ ớ ủ ử ố
khi đi n tích h t nhân tăng d n chính là nguyên nhân c a s bi n đi tu n hoàn tính ch t c a cácệ ạ ầ ủ ự ế ổ ầ ấ ủ
nguyên t .ố
Nhóm B: nguyên t d và f. (kim lo i chuy n ti p). ố ạ ể ế
2/ S bi n đi tu n hoàn m t s tính ch t c a nguyên t các nguyên t và các h p ch t ự ế ổ ầ ộ ố ấ ủ ử ố ợ ấ
c a chúngủ
* C u hình electron, Hóa tr c a các nguyên t trong oxit cao nh t, h p ch t v i hidroấ ị ủ ố ấ ợ ấ ớ
Nhóm IA IIA IIIA IVA VA VIA VIIA
C u hình e l p ngoàiấ ớ
cùng
ns1ns2ns2np1ns2np2ns2np3ns2np4ns2np5
Hóa tr / oxit cao nh tị ấ 1 2 3 4 5 6 7
CT oxit cao nh tấR2O RO R2O3RO2R2O5RO3R2O7
Hóa tr / h p ch t v iị ợ ấ ớ
H
- - - 4 3 2 1
Công th c h p ch tứ ợ ấ
v i HớRH4RH3H2R HR
* S bi n đi tính ch t khi đi n tích h t nhân tăng d nự ế ổ ấ ệ ạ ầ
Tính ch t (đi l ng)ấ ạ ượ Chu kìNhóm A
Bán kính nguyên tử
Tính kim lo iạ
Tính baz c a oxit và hidroxit t ng ngơ ủ ươ ứ Gi m d nả ầ Tăng d nầ
Đ âm đi nộ ệ
Tính phi kim
Tính axit c a oxit và hidroxit t ng ngủ ươ ứ Tăng d nầGi m d nả ầ
3. Hóa trị
Trong oxit cao nh tấ
Trong h p ch t khí v i Hiđroợ ấ ớ
Tăng t 1 đn 7ừ ế
Gi m t 4 đn 1ả ừ ế

CH NG III: LIÊN K T HÓA H CƯƠ Ế Ọ
1. Quy t c Octet (bát t ):ắ ử
L u ý: có 1 s tr ng h p không tuân theo quy t c octet (VD: PClư ố ườ ợ ắ 5, NO, BH3,...)
2. S hình thành ion, anion, cation, liên k t ion. C u trúc tinh th ion và tính ch t c a ch t có liênự ế ấ ể ấ ủ ấ
k t ion ế
3. Khái ni m, s hình thành liên k t c ng hóa tr . Cách vi t các công th c e, công th c Lewis,ệ ự ế ộ ị ế ứ ứ
CTCT. L y ví dấ ụ
4. So sánh liên k t ion và liên k t c ng hóa tr .ế ế ộ ị
LIÊN K T HÓA H CẾ Ọ
Liên k t ionếLiên k t c ng hóa trế ộ ị
Khái ni mệL c hút tĩnh đi n gi a 2ự ệ ữ
ion trái d u.ấ
S góp chung 1 hay nhi u c p e hóa tr gi a 2 nguyên t .ự ề ặ ị ữ ử
Phân lo iạ
C p electron liên k t chuy n h nặ ế ể ẳ
đn nguyên t nh n electron t oế ử ậ ạ
thành ion âm và nguyên tử
nh ng electron t o thành ionườ ạ
d ng.ươ
Không phân c cự
C p e chung gi a hai nguyênặ ở ữ
t .ử
Phân c cự
C p e chung l ch v nguyên tặ ệ ề ử
có ĐÂĐ l n h n.ớ ơ
Nh n bi tậ ế KLđi n hìnhể – PKđi n hìnhể
Ví d : NaCl, KF,…ụ
PK – PK
(2PK gi ng)ố
Ví d : Hụ2, O2,...
PK – PK or H – PK
(2PK khác nhau)
Ví d : HCl, NOụ2,…
Hi u ĐÂĐệ∆c 1,7 0 ∆c0,4 0,4 ∆c1,7
Ví dụPhân t Kử2O có
∆c = 3,44 – 0,82 = 2,62
Phân t CHử4 có
∆c = 2,55 – 2,20 = 0,35
Phân t HCl cóử
∆c = 3,16 – 2,20 = 0,96
5. Tính ch t c a các ch t có liên k t c ng hóa trấ ủ ấ ế ộ ị
6. S hình thành liên k t ự ế σ, π và năng l ng liên k tượ ế
7. Khái ni m, s hình thành liên k t hydrogen và t ng tác Van Der Waals, l y ví dệ ự ế ươ ấ ụ
BÀI T P TR C NGHI MẬ Ắ Ệ
CH NG 1: NGUYÊN TƯƠ Ử
Câu 1: Nguyên t có s proton và notron là:ử ố
A. 92p, 143p B. 92p,143n C. 92p, 235n. D. 92n, 235p.
Câu 2: Nguyên t X có t ng s h t p, n, e b ng 40, hi u s 2 lo i h t proton và n tron b ng 1. ử ổ ố ạ ằ ệ ố ạ ạ ơ ằ
X có s kh i và s hi u nguyên t là:ố ố ố ệ ử
A. A= 27, Z= 13 B. A= 28, Z= 14 C. A= 27, Z= 12 D. A= 28, Z= 13
Câu 3: Ion +
A. 11 e,11 p. B. 10 e,11 p. C. 11 e,12 p. D. 10 e,10 p.
Câu 4: Argon tách ra t không khí là h n h p c a 3 đng v : ừ ỗ ợ ủ ồ ị 40 Ar ( 99,6%); 38 Ar ( 0,063%); 36 Ar
( 0,337%). Nguyên t kh i trung bình c a Ar là:ử ố ủ
A. 38,5. B. 39,9 C. 39,1 D. 38,8
Câu 5:Trong t nhiên oxi có 3 đng v b n là ự ồ ị ề 16O, 17O, 18O, còn đng có 2 đng v b n ồ ồ ị ề 63Cu, 65Cu.
S lo i phân t đng (I) oxit khác nhau có th t o thành t các đng v b n trên là bao nhiêu?ố ạ ử ồ ể ạ ừ ồ ị ề
A. 6B. 12 C. 9 D.18
Câu 6:Cho hai nguyên t M và N có s hi u nguyên t l n l t là 11 và 13. C u hình electron ố ố ệ ử ầ ượ ấ
c a M và N l n l t là ủ ầ ượ
A. 1s22s22p63s1 và 1s22s22p63s2.B. 1s22s22p63s1 và 1s22s22p63s3.
C. 1s22s22p63s1 và 1s22s22p63s23p1.D. 1s22s22p7 và 1s22s22p63s2.
Câu 7. Cho các phát bi u sau :ể
(1) L p K là l p có m c năng l ng th p nh t.ớ ớ ứ ượ ấ ấ
(2) Các electron trên cùng m t phân l p có m c năng l ng b ng nhau.ộ ớ ứ ượ ằ
(3) Nguyên t có c u trúc đc khít, g m v nguyên t và h t nhân nguyên t .ử ấ ặ ồ ỏ ử ạ ử
(4) S đi n tích h t nhân đc tr ng cho m t nguyên t . ố ệ ạ ặ ư ộ ố
(5) H t nhân nguyên t luôn mang đi n tích d ng.ạ ử ệ ươ
(6) Các electron chuy n đng xung quanh h t nhân không theo qu đo xác đnh.ể ộ ạ ỹ ạ ị
S phát bi u ố ể đung là :
A. 2 B. 5 C. 4 D. 6
Câu 8. Cho c u hình e nguyên t c a các nguyên t sau ấ ử ủ ố
X. 1s22s22p6 3s23p4. Y. 1s22s22p6 3s1. Z. 1s22s22p6 3s23p63d10 4s1. T. 1s22s22p6
S nguyên t nguyên t là kim lo i:ố ử ố ạ
A. 1 B. 3 C. 2 D. 4
Câu 9. Aluminium có r t nhi u ng d ng trong cu c s ng. Kim lo i này đcấ ề ứ ụ ộ ố ạ ượ các th ng hi uươ ệ
t i Vi t Namạ ệ dùng đ t o thành v máy bay do đ b n ch c và m ng nhể ạ ỏ ộ ề ắ ỏ ẹ
c a nó. ủAluminium cũng đc dùg đ s n xu t các thi t b và d ng c sinhượ ể ả ấ ế ị ụ ụ
ho t nh n i, ch o, các đng dây t i đi n, các lo i c a,…ạ ư ồ ả ườ ả ệ ạ ử C u hìnhấ
electron c a nguyên t Aluminium (Z = 13) theo ô orbital là:ủ ử
A. ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑
B. ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑
C. ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑
D. ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
CH NG 2: B NG TU N HOÀN CÁC NGUYÊN T HÓA H CƯƠ Ả Ầ Ố Ọ
Câu 10:Các phát bi u sau, có bao nhiêu phát bi u đúng?ể ể
1. Có 2 lo i chu k là VII A và VII Bạ ỳ
2. Chu k 1 có s nguyên t ít nh tỳ ố ố ấ
3. Trong m t chu kì, các nguyên t đc s p x p thành c tộ ố ượ ắ ế ộ
4. Trong 1 chu kì các nguyên t có tính ch t hóa h c t ng t nhauố ấ ọ ươ ự
A.1B.2C.3D.4



![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)










![Phiếu bài tập cuối tuần Tiếng Việt 1 tuần 2 đề 2: [Hướng dẫn chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250728/thanhha01/135x160/42951755577464.jpg)

