
Trường THCS Lê Cơ
Họ và tên:……………………..……… Lớp: 9/….
KIỂM TRA GIỮA KỲ
HỌC KỲ I, NĂM HỌC 2023-2024
MÔN: HÓA HỌC – LỚP: 9
Thời gian làm bài: 45 phút (Không kể thời gian giao đề)
ĐIỂM: NHẬN XÉT CỦA THẦY/CÔ:
A. TRẮC NGHIỆM KHÁCH QUAN: ( 5 điểm)
I. Khoanh tròn vào chữ cái (A hoặc B, C, D) đứng đầu ý trả lời đúng.
Câu 1: Chất tác dụng với nước tạo ra dung dịch bazơ là
A. CO2 B. Na2O C. SO2 D. P2O5
Câu 2: Sản phẩm của phản ứng phân hủy canxi cacbonat bởi nhiệt là
A. CaO và CO B. CaO và H2O
C. CaO và SO2 D. CaO và CO2
Câu 3: Dãy oxit nào sau đây vừa tác dụng với nước vừa tác dụng với axit?
A. CaO, CuO, SO3 B. BaO, Na2O, K2O
C. CO2, SO2, Al2O3 D. P2O5, SO2, MgO
Câu 4: Cặp chất tác dụng với nhau tạo ra khí lưu huỳnh đioxit là
A. CaCO3 và HCl B. Na2SO3 và H2SO4
C. CuCl2 và KOH D. K2CO3 và HNO3
Câu 5: Chất nào sau đây dùng làm chất tẩy trắng trong công nghiệp giấy, vải, diệt nấm mốc?
A. N2O5 B. CO2 C. CaO D. SO2
Câu 6: Oxit được dùng làm chất hút ẩm (chất làm khô) trong phòng thí nghiệm là
A. CuO B. ZnO C. PbO D. CaO
Câu 7: Dùng quì tím phân biệt được cặp chất nào sau đây?
A. Dung dịch HCl và dung dịch KOH B. Dung dịch HCl và dung dịch H2SO4
C. Dung dịch Na2SO4 và dung dịch NaCl D. Dung dịch NaOH và dung dịch KOH
Câu 8: Cặp chất nào sau đây xảy ra phản ứng?
A. Na2O + NaOH B. Cu + HCl
C. P2O5 + H2SO4 D. Cu + H2SO4 đặc nóng
Câu 9: Axit sunfuric loãng tác dụng được với dãy chất nào sau đây ?
A. Zn, CO2, NaOH. B. Zn, Cu, CaO
C. Zn, H2O, SO3. D. Zn, NaOH, Na2O
Câu 10: Dãy các bazơ bị phân hủy ở nhiệt độ cao là
A. NaOH, Zn(OH)2, Fe(OH)3 B. Cu(OH)2, NaOH, Mg(OH)2
C.Cu(OH)2, Mg(OH)2, Zn(OH)2 D. Zn(OH)2, Ca(OH)2, KOH,
Câu 11: Nước chanh ép có tính axit. Vậy nước chanh ép có
A. pH < 7 B. pH = 7 C. pH > 7 D. 7 < pH < 9
Câu 12: Điện phân dung dịch NaCl bão hoà có màng ngăn giữa hai điện cực, sản phẩm thu được là
A. NaOH, H2, Cl2 B. NaCl, H2O, Cl2
C. NaCl, NaClO, Cl2 D. NaClO, H2 và Cl2
Câu 13: Dung dịch CuCl2 tác dụng được với
A. dung dịch NaOH B. dung dịch HCl
C. dung dịch Zn(NO3)2 D. dung dịch BaCl2
Câu 14: Phản ứng hóa học nào sau đây thuộc loại phản ứng trao đổi?
A. Muối với kim loại B. Phân hủy muối C. Muối với axit D. Oxit với nước
Câu 15: Cặp chất nào có thể cùng tồn tại trong một dung dịch?
A. NaOH và HBr B. H2SO4 và BaCl2
C. KCl và NaNO3 D. NaCl và AgNO3
de_thi_giua_hoc_ki_1_mon_hoa_hoc_lop_9_nam_2023_2024_co_dap_an_truong_thcs_le_co_tien_phuoc_987.doc
A

B. TỰ LUẬN: ( 5 điểm)
Câu 1: (2 đ) Viết phương trình hóa học thực hiện dãy chuyển đổi sau.
CuSO4
(1)
Cu(OH)2
(2)
CuO
(3)
CuCl2
(4)
AgCl
...............................................................................................................................................................
.......................................................................................................................................
...............................................................................................................................................................
.......................................................................................................................................
Câu 2: (1đ)Bằng phương pháp hóa học hãy phân biệt các dung dịch chứa trong các lọ riêng biệt bị
mất nhãn: NaOH, H2SO4, Ca(OH)2, NaCl. Viết phương trình phản ứng xảy ra (nếu có).
...............................................................................................................................................................
....................................................................................................................................... .......................
...............................................................................................................................................................
................................................................................................................
...............................................................................................................................................................
.......................................................................................................................................
Câu 3:(2 đ).Hòa tan kim loại Mg vào 200ml dung dịch HCl vừa đủ, sau phản ứng thu được 4,48lít
khí (ở đktc) và dung dịch A.
a. Tính khối lượng Mg phản ứng.
b. Tính nồng độ mol của dung dịch HCl đã dùng.
c. Cho dung dịch chỉ có chứa 20gam NaOH vào dung dịch A đến khi phản ứng kết thúc thì lọc lấy
kết tủa đem nung trong không khí đến khối lượng không đổi thu được m gam chất rắn. Tính m.
Cho biết: Cl = 35.5; O=16; S=32; H=1; Mg =24, Na = 23
…………………………………………………………………………………………………………
…………………………………………………………………………………………………………
…………………………………………………………………………………………………………
…………………………………………………………………………………………………………
…………………………………………………………………………………………………………
…………………………………………………………………………………………………………
…………………………………………………………………………………………………………
…………………………………………………………………………………………………………
…………………………………………………………………………………………………………
…………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………
de_thi_giua_hoc_ki_1_mon_hoa_hoc_lop_9_nam_2023_2024_co_dap_an_truong_thcs_le_co_tien_phuoc_987.doc

KIỂM TRA GIỮA HỌC KÌ I, NĂM HỌC 2023 - 2024
HƯỚNG DẪN CHẤM MÔN: HÓA HỌC – LỚP: 9
A/ TRẮC NGHIỆM: ( 5 ĐIỂM)
Chọn đúng mỗi đáp án ghi 0.3đ, sai 2 đáp án trừ 0.7đ, sai 3 đáp án trừ 1đ
CÂU 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
Đ/A B D B B D D A D D C A A A C C
B/ TỰ LUẬN: (5 ĐIỂM)
Câu 1:(2 đ)
- Viết đúng mỗi phương trình được 0,5 điểm.
- Thiếu điều kiện p/ư hoặc cân bằng sai trừ 0.25 điểm trên mỗi phương trình.
Câu 2:(1.đ)
- Dùng quỳ tím nhận ra NaCl( không đổi màu) được 0,25 điểm, nhận ra H2SO4 ( hóa đỏ)
được 0,25 điểm.
- Dùng CO2 nhận ra Ca(OH)2 được 0,25 điểm.
- Viết phương trình 0,25 điểm.
Câu 3:(2.đ)
a.
- Viết đúng phương trình 0,25 điểm
- Tính nH2 = 0,2 mol 0,25 điểm
- Tính được khối lượng Mg = 4,8 gam 0,25 điểm
b.
- Tính được số mol của HCl = 0,4 mol 0,25 điểm
- Tính được nồng độ mol của HCl = 2M 0,25 điểm
c.
- Tính nNaOH = 0,5 mol
- Viết đúng 2 phương trình 0,25 điểm
- Lập tỉ lệ so sánh, xác định được NaOH dư 0,25 điểm
- Tính được khối lượng MgO = 8 gam 0,25 điểm
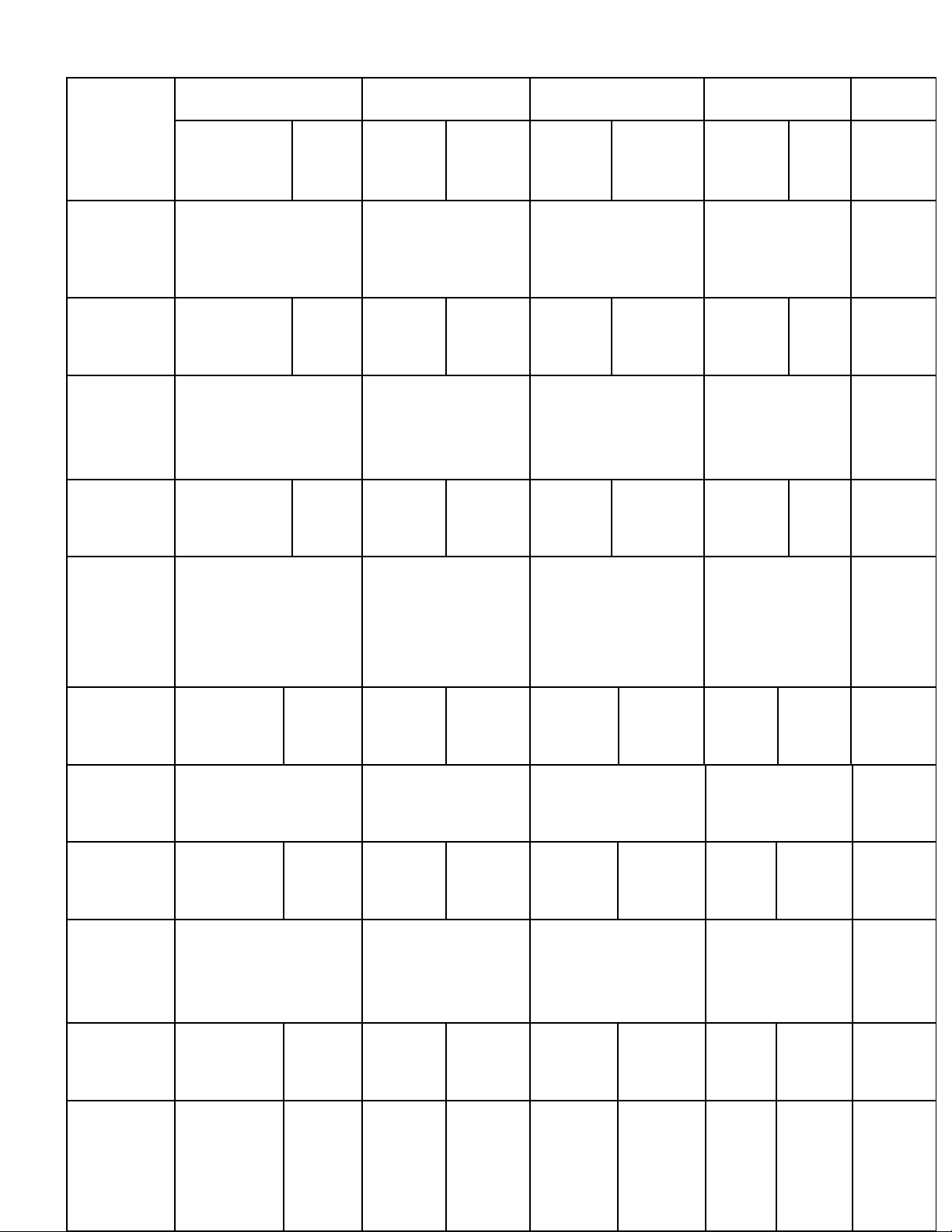
KHUNG MA TRẬN KIỂM TRA GIỮA KÌ I NĂM HỌC 2023 – 2024
Môn: Hóa học – Lớp 9
de_thi_giua_hoc_ki_1_mon_hoa_hoc_lop_9_nam_2023_2024_co_dap_an_truong_thcs_le_co_tien_phuoc_987.doc

de_thi_giua_hoc_ki_1_mon_hoa_hoc_lop_9_nam_2023_2024_co_dap_an_truong_thcs_le_co_tien_phuoc_987.doc
de_thi_giua_hoc_ki_1_mon_hoa_hoc_lop_9_nam_2023_2024_co_dap_an_truong_thcs_le_co_tien_phuoc_987.doc
Tên Chủ
đề
(nội dung,
chương…)
Nhận biết Thông hiểu Vận dụng Vận dụng cao Cộng
TNKQ TL TNKQ TL TNKQ TL TNKQ TL
Chủ đề 1:
Oxit
- Sản xuất một số
oxit quan trọng.
-Ứng dụng của oxit.
- Tính chất hóa
học của oxit
Số câu
Số điểm
Tỉ lệ %
4
1,3đ
13%
2
0,7đ
7%
6
2,0đ
20%
Chủ đề 2:
Axit
- Tính chất hóa học
của axit, H2SO4đặc
- Tính khối lượng
KL
- Tính nồng độ
mol của dung dịch
Số câu
Số điểm
Tỉ lệ %
3
1đ
10%
2/3
1,25đ
12,5%
3+2/3
2,25đ
22,5%
Chủ đề 3:
Bazơ
- Tính chất hóa học
của bazơ
- Thang pH
- Sản xuất bazơ quan
trọng
Số câu
Số điểm
Tỉ lệ %
3
1đ
10%
3
1đ
10%
Chủ đề 4:
Muối
- Tính chất hóa học
của muối, xác định
loại phản ứng
- Tính chất hóa
học của muối.
2
0,7đ
7%
1
0,3đ
3%
3
1đ
10%
Chủ đề 5:
Tổng hợp
Viết các PTHH
thực hiện dãy
chuyển hóa
- Nhận biết các
dung dịch
Tính khối
lượng oxit sau
phản ứng phân
hủy bazơ
1
2đ
20%
1
1,0đ
10%
1/3
0.75đ
7.5%
2+1/3
3,75đ
37,5%
Tổng số
câu
Tổng số
điểm
Tỉ lệ %
12
4,0đ
40%
3
1,0đ
10%
1
20đ
20%
1+1/3
2,25đ
22,5%
1/3
0.75đ
7.5%
18
10 đ
100%



![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)




![Đề thi học kì 2 Vật lý lớp 11: Đề minh họa [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250709/linhnhil/135x160/711752026408.jpg)







