
PHÒNG GIÁO DỤC VÀ ĐÀO TẠO ĐÔNG HƯNG
MA TRẬN ĐỀ KIỂM TRA GIỮA KÌ II HÓA HỌC 8
NỘI DUNG
KIẾN THỨC
CẤP ĐỘ NHẬN THỨC TỔNG
ĐIỂM
Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao
TNKQ TL TNKQ TL TNKQ TL TNKQ TL
Tính chất của oxi;
Sự oxi hóa – phản ứng hóa
hợp - ứng dụng của oxi
2 câu
0,5 điểm
1 câu
1 điểm
1 câu
0,25 điểm
1 câu
1 điểm
1 câu
0,25 điểm
1/2 câu
0,5 điểm
Số câu: 6,5
Điểm: 3.5
Tỷ lệ: 35%
Oxit; Điều chế oxi –phản
ứng phân hủy 3 câu
0,75 điểm
1 câu
1 điểm
1 câu
0.25 điểm
1 câu
1 điểm
2 câu
0.5 đ
Số câu: 8
Điểm: 3.5
Tỷ lệ: 35%
Không khí – sự cháy.
1 câu
0,25 điểm
Số câu: 1
Điểm: 0.25
Tỷ lệ: 2,5%
Tính chất - ứng dụng của
hiđro; điều chế khí hiđro –
phản ứng thế
2 câu
0.5 điểm
2 câu
0.5 điểm
1 câu
0,25 điểm
1/2 câu
0,5 điểm
1 câu
1 điểm
Số câu: 6,5
Điểm: 2,75
Tỷ lệ: 27,5%
Tổng số câu: 14
Tổng số điểm: 10
Tỷ lệ: 100%
Số câu: 10
Điểm: 4
Tỷ lệ: 40%
Số câu: 6
Điểm: 3
Tỷ lệ: 30%
Số câu: 5,5
Điểm: 2
Tỷ lệ: 20%
Số câu: 1
Điểm: 1
Tỷ lệ: 10%
Số câu: 15
Điểm: 10
Tỷ lệ: 100%

PHÒNG GD & ĐT ĐÔNG HƯNG
TRƯỜNG THCS TRỌNG QUAN
ĐỀ KIỂM TRA KHẢO SÁT CHẤT LƯỢNG GIỮA KÌ II
Năm học: 2022- 2023
MÔN: Hóa 8
Thời gian làm bài: 45 phút
ĐỀ 1
Phần 1: Trắc nghiệm (4đ).
Câu 1: Đốt cháy dây Al trong không khí được sản phẩm là:
A. Al2O3 B. AlO C. Al2O D. AlO2
Câu 2: Dãy chất nào trong số những chất sau đây được dùng để điều chế oxi trong phòng thí nghiệm :
A. H2O, KClO3 B. Không khí, KMnO4 C. KMnO4, KClO3 D. CaCO3, H2O
Câu 3: Phản ứng sau phản ứng nào là phản ứng phân hủy?
A. 2 2 2
2 2
o
t
H O H O B. 3 2
2 2 3
o
t
KClO KCl O
C. 2 2
o
t
C O CO D. 2 3 2
3 2 3
o
t
CO Fe O Fe CO
Câu 4: Đâu không phải là tính chất vật lí của oxi
A. Ít tan trong nước C. Dập tắt đám cháy
B. Nặng hơn không khí D. Cần thiết cho hoạt động sống của sinh vật
Câu 5: Chất nào sau đây không phải là oxit
A. CuO B. CaCO3 C. Na2O D. CO2
Câu 6: Tìm phát biểu đúng:
A. Trong không khí có 78%N2, 21% O2, 1% khí khác.
B. Trong không khí có 78% O2, 21% N2, 1% khí khác
C. Qúa trình đốt nhiên liệu không làm thay đổi lượng oxi trong không khí
D. Sự cháy không ảnh hưởng gì đến không khí.
Câu 7: Cặp chất dùng để điều chế hidro trong phòng thí nghiệm là:
A. Cu và HCl B. Zn và HCl C. Na và HCl D. H2O và CaO
Câu 8: Hiện tượng khi dẫn khí hidro qua bột CuO đun nóng là:
A. Có khí bay lên C. Chất rắn màu đen xuất hiện
B. Không có hiện tượng gì D. Chất rắn chuyển từ màu đen sang màu đỏ
Câu 9: Cho các phản ứng sau, có bao nhiêu phản ứng thế?
2KMnO4 K2MnO4 + MnO2 + O2 CaO + CO2 CaCO3 2HCl + Fe FeCl2 + H2
Cu(OH)2 CuO + H2O CuO + H2 -> Cu + H2O Fe2O3 + 3C -> 2Fe + 3CO2
A. 2 B. 3 C. 4 D. 5
Câu 10: Cho pư Fe3O4 + H2 Fe + H2O. Tổng hệ số tối giản của pư trên sau khi đã cân bằng là:
A. 9 B. 10 C. 11 D. 12
Câu 11: Cặp chất dùng để điều chế oxi trong công nghiệp là:
A. KMnO4, KClO3 B. Không khí, nước
B. KClO3, nước D. Không khí, KMnO4, KClO3
Câu 12: Cho pư đốt cháy chất X trong oxi như sau: X + O2 CO2 + H2O. Vậy chất X có thể là:
A, CH4 B. C2H5OH C. C4H10 D. Cả A, B, C đều đúng
Câu 13: Tính khối lượng sản phẩm thu được khi đốt cháy 16.8 gam sắt trong khí oxi dư:

A. 48 g B. 23.2 g C. 24 g D. 69.6 g
Câu 14: Oxit trong đó nguyên tố X chiếm 40% là:
A. CuO B. Fe2O3 C. SO2 D. SO3
Câu 15: Cho các chất sau, C, P, Cu, Fe, Al, S, Na có bao nhiêu chất tác dụng với khí oxi khi đun nóng
thu được sản phẩm là oxit bazo
A. 2 B. 3 C. 4 D. 5
Câu 16: Dãy các oxit đều pư với khí HIDRO khi đun nóng là:
A. CuO, FeO B. CuO, MgO C. Al2O3, FeO D. Cả 3 đáp án trên
Phần 2: Tự luận (6 đ)
Câu 1 (1đ): Viết phản ứng đốt cháy từng chất sau trong không khí: Al, C2H5OH
Câu 2 (1 đ): Viết 2 pư điều chế hidro trong phòng thí nghiệm
Câu 3 (1đ): Tính phần trăm khối lượng của từng nguyên tố trong hợp chất sắt (III) oxit
Câu 4 (1đ): Hoàn thành bảng sau:
Công thức Tên gọi Công thức Tên gọi
SO3 Fe3O4
CuO P2O5
CaO Na2O
Câu 5 (1đ):
a.. Nhiệt phân hết 31.6 gam KClO3. Tính thể tích khí oxi thu được ở đktc
b. Lượng oxi ở trên đủ để đốt cháy bao nhiêu gam khí hidro?
Câu 6 (1đ) Cho m gam hỗn hợp gồm Al, Zn tác dụng đủ với dung dịch chứa 14.6 gam HCl, sau pư thu
được V lít khí ở đktc.
a. Viết các phương trình phản ứng.
b. Tính V lít thể tích khí thu được ở đktc
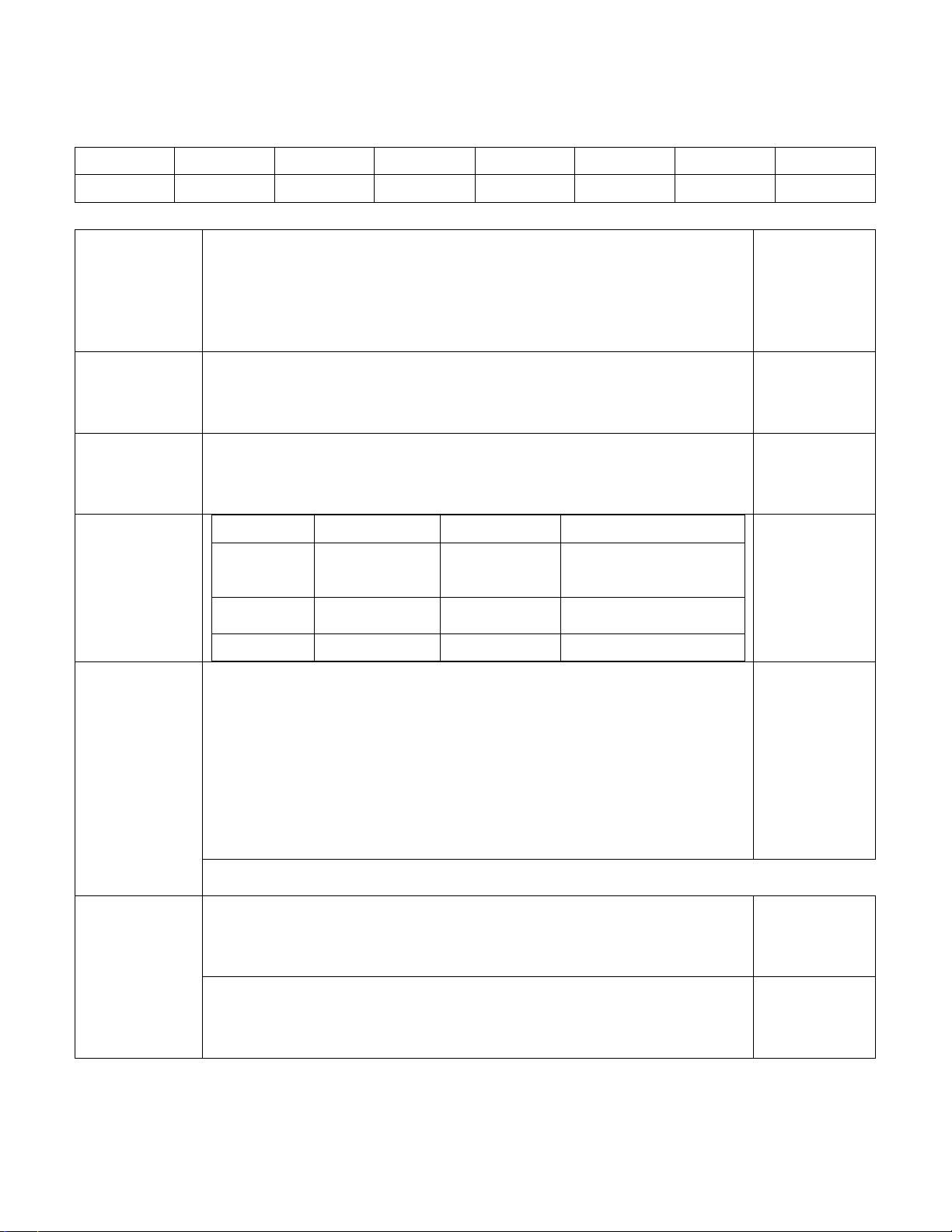
ĐÁP ÁN
Phần 1: Trắc nghiệm
Mỗi câu đúng được 0.25 điểm
1A 2C 3B 4C 5B 6A 7B 8D
9B 10D 11B 12D 13B 14D 15C 16A
Phần 2: Tự luận
Câu 1
1đ 4Al + 3O2 2Al2O3
C2H5OH + 3O2 2CO2 +3 H2O
Mỗi PT đúng
được 0.25
điểm
Câu 2
1 đ
Zn + 2HCl ZnCl2 + H2
2 Al + 6HCl 2AlCl3 + 3H2
Mỗi PT đúng
được 0.25
điểm
Câu 3
1 đ
Fe2O3
%Fe = 70%
%O = 30%
Câu 4
1 đ
Công thức Tên gọi Công thức Tên gọi
SO3 Lưu huỳnh tri
oxit
Fe3O4 Sắt từ oxit
CuO Đồng II oxit P2O5 Đi photpho penta oxit
CaO Canxi oxit Na2O Natri oxit
1 đ
Câu 5
1đ
a. Số mol KClO3 = 0.2 mol
2KClO3 2KCl + 3 O2
mol O2 = 0.3 mol
THể tích oxi là: 6.72 lít
b. 2H2 + O2 2H2O
Số mol H2 = 0.6 mol
Khối lượng H2 = 1.2 g
0.5 đ
0.5 đ
Câu 6
1đ
a.
2 Al + 6HCl 2AlCl3 + 3H2
Zn + 2HCl ZnCl2 + H2
0.25đ
0.25đ
b.. Số mol HCl = 0.2 mol
Số mol H2 = ½ mol HCl = 0.1 mol
Thể tích H2 = 2.24 lít
0.5đ

PHÒNG GD & ĐT ĐÔNG HƯNG
TRƯỜNG THCS TRỌNG QUAN
ĐỀ KIỂM TRA KHẢO SÁT CHẤT LƯỢNG GIỮA KÌ II
Năm học: 2022-2023
MÔN: Hóa 8
Thời gian làm bài: 45 phút
ĐỀ 2
Phần 1: Trắc nghiệm (4đ).
Câu 1: Đốt cháy dây Mg trong không khí được sản phẩm là:
A. MgO B. MgO2 C. Mg2O D. Mg2O2
Câu 2: Dãy chất nào trong số những chất sau đây được dùng để điều chế oxi trong công nghiệp
A. H2O, KClO3 B. Không khí, KMnO4 C. Nước, không khí D. CaCO3, H2O
Câu 3: Phản ứng sau phản ứng nào là phản ứng hoá hợp?
A. 3 2
2 2 3
o
t
KClO KCl O B. 2 2 2
2 2
o
t
H O H O
C. NaOH + HcL NaCl + H2O D. 2 3 2
3 2 3
o
t
CO Fe O Fe CO
Câu 4: Chất nào không pư với khí oxi
A. Fe B. Ag C. CH4 D. P
Câu 5: Chất nào sau đây là oxit bazo
A. SO2 B. CaO C. NO D. H2CO3
Câu 6: Tìm phát biểu đúng:
A. Trong không khí có 78%N2, 21% O2, 1% khí khác.
B. Trong không khí có 78% O2, 21% N2, 1% khí khác
C. Qúa trình đốt nhiên liệu không làm thay đổi lượng oxi trong không khí
D. Sự cháy không ảnh hưởng gì đến không khí.
Câu 7: HIDRO không pư với chất nào sau đây ngay cả khi đun nóng
A. CuO B. Al2O3 C. FeO D. Fe3O4
Câu 8: Hiện tượng khi dẫn khí hidro qua bột CuO đun nóng là:
A. Có khí bay lên C. Chất rắn màu đen xuất hiện
B. Không có hiện tượng gì D. Chất rắn chuyển từ màu đen sang màu đỏ
Câu 9: Cho các phản ứng sau, có bao nhiêu phản ứng dùng để điều chế hidro trong phòng thí nghiệm
Zn + 2HCl ZnCl2 + H2 2H2O 2 H2 + O2
2HCl + Fe FeCl2 + H2 2 Na + 2H2O 2 NaOH + H2
A. 1 B. 2 C. 3 D. 4
Câu 10: Cho pư: Fe2O3 + H2 Fe + H2O. Tổng hệ số tối giản của pư trên sau khi đã cân bằng là:
A. 8 B. 10 C. 11 D. 9
Câu 11: Cặp chất dùng để điều chế oxi trong phòng thí nghiệm là:
A. Không khí, nước B. KMnO4, KClO3
C. KClO3, nước D. Không khí, KMnO4, KClO3
Câu 12: Cho pư đốt cháy chất X trong oxi như sau: X + O2 CO2 + H2O. Vậy chất X có thể là:
A, CH4 B. C2H5OH C. C4H10 D. Cả A, B, C đều đúng
Câu 13: Tính khối lượng sản phẩm thu được khi đốt cháy 5.4 gam nhôm trong khí oxi dư:
A. 12 g B. 10.2 g C. 16 g D. 20 g



![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)




![Đề thi học kì 2 Vật lý lớp 11: Đề minh họa [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250709/linhnhil/135x160/711752026408.jpg)







