
SỞ GD&ĐT TỈNH ĐIỆN BIÊN
TRƯỜNG THPT PHAN ĐÌNH GIÓT
Đề chính thức
(Đề gồm có 04 trang)
ĐỀ KIỂM TRA, ĐÁNH GIÁ GIỮA HỌC KỲ II
MÔN: HÓA HỌC – LỚP 10
Năm học 2022- 2023
Thời gian làm bài: 45 phút
Họ tên học sinh: ..........................................................
Lớp: ...........
Mã đề 001
ĐIỂM LỜI PHÊ CỦA GIÁO VIÊN
I. PHẦN TRẮC NGHIỆM: (7,0 điểm)
Câu 1: Trong phản ứng hóa học: 2K + 2H2O"→"2KOH + H2, chất oxi hóa là
A. "K. B. "H2O. C. "H2.D. "KOH.
Câu 2: Tính biến thiên enthalpy của phản ứng theo năng lượng liên kết khi các chất ở trạng thái
nào?
A. Chất lỏng B. Chất rắn C. Chất khí D. Cả 3 trạng thái
trên.
Câu 3.DCho phản ứng đơn giản có dạng: aA + bB ⟶ cC + dD
Mối quan hệ giữa nồng độ và tốc độ tức thời của phản ứng hóa học được biểu diễn bằng biểu thức
A."ν"="k.CAa.CBbB."ν"="k.CA.CB
C."ν"="CAa.CBb D."ν"="k.CAa.CBb.CCc.CDd
Câu 4: Trong hợp chất, số oxi hóa của H thường là
A. +1 B. -2. C. -1 D. +2
Câu 5: Để tính biến thiên enthalpy phản ứng theo năng lượng liên kết, phải viết được
A. công thức phân tử của tất cả các chất trong phản ứng
B. công thức cấu tạo của tất cả các chất trong phản ứng
C. công thức đơn giản nhất của tất cả các chất trong phản ứng
D. Cả A, B và C đều sai
Câu 6: Phản ứng xảy ra khi pin được sử dụng trong điện thoại, máy tính, … giải phóng năng
lượng dưới dạng
A. "nhiệt năng. B. "hóa năng. C. "điện năng. D. "cơ năng.
Câu 7: Dấu hiệu để nhận biết một phản ứng oxi hóa - khử là
A. Có sự thay đổi số oxi hóa của các nguyên tử. B. Có xuất hiện sản phẩm là chất kết tủa.
C. Có xuất hiện hiện sản phẩm là chất khí. D. Có sự thay đổi trạng thái của chất phản
ứng.
Câu 8:DCho phản ứng đơn giản xảy ra trong bình kín: 2CO(g) + O2(g) ⟶ 2CO2(g).
Tốc độ phản ứng thay đổi như thế nào nếu tăng nồng độ CO gấp 2 lần, nồng độ O2"không đổi?
A."tăng gấp 4 lần B."tăng gấp 8 lần C."không thay đổi D."giảm 2 lần
Câu 9. Tốc độ phản ứng phụ thuộc vào các yếu tố sau:
A. Nhiệt độ . B. Nồng độ, áp suất.
Trang 1/5 - Mã đề 001
C. Chất xúc tác, diện tích bề mặt . D. Cả A, B và C.
Câu 10: Cho phản ứng: . Ban đầu nồng độ của N2O5 là 1,91M, sau 207
giây nồng độ của N2O5 là 1,67M. Tốc độ trung bình của phản ứng tính theo N2O5 là:
A. 3,8.10−4 mol/(l.s).B. 1,72.10−3 mol/(l.s).
C. 1,16.10−3 mol/(l.s). D. 1,8.10−3 mol/(l.s)
Câu 11: Trong phản ứng oxi hóa - khử, chất oxi hóa là chất
A. nhường electron."""""""""""""""""""""" B. nhận proton.
C. nhận electron."""""""""""""""""""""""""" D. nhường proton.
Câu 12: Số oxi hóa của nguyên tử N trong hợp chất NO2 là
A. +2. B. +4. C. 1. D. +6.
Câu 13: Điều kiện để xảy ra phản ứng tỏa nhiệt?
A. > 0. B. < 0. C. ≠ 0. D. = 0.
Câu 14: Khi đun nấu thức ăn, nếu củi được chẻ nhỏ thì quá trình cháy xảy ra nhanh hơn. Vậy
người ta đã dựa vào yếu tố nào sau đây để tăng tốc độ phản ứng?
A. nồng độ B. nhiệt độ C. diện tích tiếp xúc D. áp suất
Câu 15: Trong phản ứng hóa học: Zn + H2SO4"→"ZnSO4"+ H2, mỗi nguyên tử Zn đã
A. "nhường 2 electron. B. "nhận 1 electron.
C. "nhường 1 electron. D. "nhận 2 electron.
Câu 16: Cho các phương trình nhiệt hóa học:
(1) CaCO3(s) CaO(s) + CO2(g) ∆rH = +176,0 kJ.
(2) C2H4(g) + H2(g) C2H6(g) ∆rH = -137,0 kJ.
(3) Fe2O3(s) + 2Al(s) Al2O3(s) + 2Fe(s) ∆rH = -851,5 kJ.
Trong các phản ứng trên,phản ứng nào tỏa nhiệt là
A. (2), (3). B. (1), (3). C. (1). D. (2).
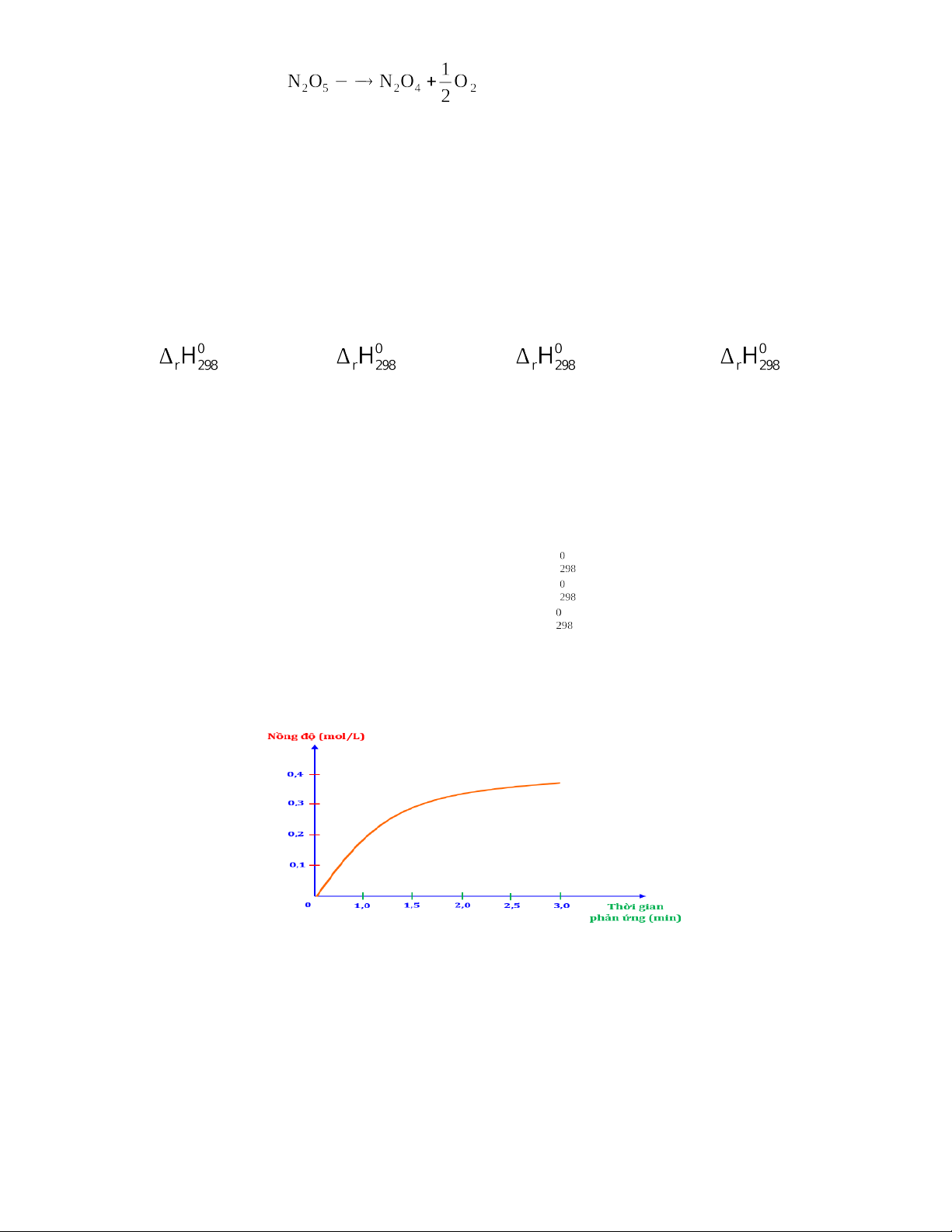
Câu 17: Xét phản ứng : H2"+ Cl2"→"2HCl.
Nghiên cứu sự thay đổi nồng độ một chất trong phản ứng theo thời gian, thu được đồ thị sau:
Đồ thị này mô tả sự thay đổi nồng độ theo thời gian của chất nào?
A. Nồng độ của HCl theo thời gian. B. Nồng độ của H2 của theo thời gian.
C. Nồng độ của Cl2 theo thời gian. D. Nồng độ của Cl2 hoặc H2 theo thời
gian.
Câu 18: Trong phản ứng oxi hóa - khử, chất khử có số oxi hóa biến đổi như thế nào?
A. Giảm. B. Tăng. C. Không đổi. D. Giảm rồi tăng.
Câu 19: Cho quá trình Fe+2 Fe+3 + 1e, đây là quá trình
A. oxi hóa. B. khử . C. nhận proton. D. tự oxi hóa – khử.
Trang 2/5 - Mã đề 001
Câu 20: Phản ứng hóa học: CO(g) + O2(g)→ CO2(g) có ∆rH = -283,0 kJ
Biết nhiệt tạo thành chuẩn của CO2 = -393,5 kJ/mol. Nhiệt tạo thành chuẩn của CO là
A. -110,5 kJ/mol. B. +110,5 kJ/mol. C. -296,8 kJ/mol. D. -221,0 kJ/mol.
Câu 21: Cho phản ứng hóa học: Cu + HNO3 Cu(NO3)2 + NO2 + H2O. Tổng hệ số (các số
nguyên, tối giản) của tất cả các chất trong phương trình phản ứng là
A. 10. B. 11. C. 8. D. 9.
Câu 22: Các quá trình sau
(a) Sắt bị han gỉ.
(b) Đốt cháy than trong không khí.
(c) Luyện gang từ quặng hematite đỏ.
(d) Hòa tan muối vào nước.
(e) Nung đá vôi để sản xuất vôi sống
Số phản ứng oxi hóa – khử là:
A. 1. B. 4. C. 3. D. 2.
Câu 23: Cho các chất sau, chất nào có ∆fH0298 ≠ 0?
A. N2(g).B. SO2(g).C. Na(s).D. O2(g).
Câu 24: Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
Liên kết H - H Cl - Cl H - Cl
Eb (kJ/mol) 436 243 432
Biến thiên enthalpy của phản ứng H2(g) + Cl2(g) 2HCl(g) có giá trị là
A. +471kJ. B. –185kJ. C. –235 kJ. D. +247kJ.
Câu 25:Nhiệt tạo thành chuẩn có kí hiệu là :
A. . B. . C. . D. .
Câu 26: Phản ứng tỏa nhiệt là
A. "phản ứng trong đó có sự trao đổi electron.
B. "phản ứng tỏa năng lượng dưới dạng nhiệt.
C. "phản ứng trong đó có tạo thành chất khí hoặc kết tủa.
D. "phản ứng thu năng lượng dưới dạng nhiệt.
Câu 27.DCho phản ứng: 2CO(g) + O2(g) ⟶ 2CO2(g) Với hệ số nhiệt độ Van’t Hoff" γ=2.
Tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ phản ứng từ 40°C lên 70°C?
A."tăng gấp 2 lần B."tăng gấp 8 lần C."giảm 4 lần D."tăng gấp 6 lần.
Câu 28: So sánh tốc độ của 2 phản ứng sau (thực hiện ở cˆng nhiệt độ, thành phần Zn như
nhau) :
Zn + dung dịch CuSO4 1M (1)
Zn + dung dịch CuSO4 2M (2)
Kết quả thu được là
A. (1) nhanh hơn (2). B. (2) nhanh hơn (1). C. như nhau. D. không xác định.
II . PHẦN TỰ LUẬN (3,0 điểm)
Câu 1: (1,0 điểm) Lập phương trình hóa học của phản ứng oxi hóa - khử sau:
C + HNO3 → CO2 + NO2 + H2O
Trang 3/5 - Mã đề 001

Câu 2: (1,0 điểm) Cho nhiệt tạo thành chuẩn của một số chất như sau:
Chất NH3(g) NO(g) H2O(l)
∆fH0298 (kJ/mol) -45,9 +90,3 -285,8
Hãy tính biến thiên enthalpy chuẩn của phản ứng sau và cho biết phản ứng đó tỏa nhiệt hay thu
nhiệt?
2NH3(g) + O2(g)"→ 2NO(g) + 3H2O(l)
Câu 3: (1,0 điểm) Cho phản ứng: 2A + B C
Ở một nhiệt độ xác định, hằng số tốc độ của phản ứng này là 2,5.10-4L/(mol.s). Nồng độ ban đầu
của A và B lần lượt là 0,06M và 0,04M. Hãy tính tốc độ phản ứng:
a, Tại thời điểm đầu.
b, Tại thời điểm đã hết một nửa lượng B.
BÀI LÀM
I . PHẦN TRẮC NGHIỆM
Câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14
Đáp
án
Câu 15 16 17 18 19 20 21 22 23 24 25 26 27 28
Đáp
án
II . PHẦN TỰ LUẬN
Trang 4/5 - Mã đề 001

Trang 5/5 - Mã đề 001



![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)




![Đề thi học kì 2 Vật lý lớp 11: Đề minh họa [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250709/linhnhil/135x160/711752026408.jpg)







