
PHÒNG GD&ĐT TIÊN PHƯỚC
TRƯỜNG TH&THCS NGUYỄN DU
(Đề gồm có 02 trang)
KIỂM TRA CUỐI KỲ I NĂM HỌC 2023-2024
Môn: HÓA HỌC – Lớp 9
Thời gian: 45 phút (không kể thời gian giao đề)
A. TRẮC NGHIỆM KHÁCH QUAN: (5 điểm)
Em hãy chọn phương án trả lời đúng nhất cho những câu sau đây:
Câu 1. Oxit bazơ không có tính chất hóa học nào sau đây?
A. Một số oxit bazơ tác dụng được với nước ở điều kiện thường.
B. Oxit bazơ tác dụng được với dung dịch axit.
C. Oxit bazơ tác dụng được với tất cả kim loại.
D. Một số oxit bazơ tác dụng được với oxit axit.
Câu 2: Hiđroxit nào dưới đây bị nhiệt phân hủy?
A. NaOH. B. Cu(OH)2. C. KOH. D. Ca(OH)2.
Câu 3: Chất nào làm đổi màu quỳ tím thành đỏ?
A. NaOH B. HCl C. NaCl D. H2O
Câu 4. Chất nào sau đây được dùng làm phân đạm?
A. KCl. B. Ca3(PO4)2. C. K2SO4. D. (NH2)2CO.
Câu 5 .Dung dịch tác dụng với CuSO4 tạo ra sản phẩm là kết tủa có màu xanh lam là
A. dung dịch NaOH C. dung dịch HCl
B. dung dịch Na2CO3 D. dung dịch CaCl2
Câu 6. Đinh sắt để trong môi trường nào trong số các môi trường sau đây dễ bị ăn
mòn nhất?
A. Không khí khô.
B. Dung dịch muối ăn, có tiếp xúc với không khí.
C. Nước có hòa tan khí oxi (tiếp xúc với không khí).
D. Nước cất, không tiếp xúc với không khí.
Câu 7. Các kim loại đều phản ứng với nước ở nhiệt độ thường là
A. Na, Al ; B. K, Na ; C. Al, Cu ; D. Mg, K
Câu 8 . Đuyra là hợp kim của nhôm với đồng và một số nguyên tố như mangan, sắt,
silic,… được dùng trong công nghiệp chế tạo máy bay, ô tô, tàu vũ trụ do có tính chất
nào sau đây?
A. Dẫn điện tốt. C. Bền và nhẹ.
B. Khối lượng riêng lớn. D. Dẫn nhiệt tốt.
Câu 9. Để phân biệt 2 dung dịch Na2CO3 và Na2SO4 dùng thuốc thử nào
sau đây?
A. BaCl2; B. NaOH ; C. HCl ; D. H2O
Câu 10. Nguyên tắc sản xuất gang là
A. Khử sắt oxit bằng C ở nhiệt độ cao
B. Khử sắt oxit bằng Al ở nhiệt độ cao
C. Khử sắt oxit bằng chất khử bất kỳ ở nhiệt độ cao
D. Khử sắt oxit bằng CO ở nhiệt độ cao
Câu 11. Một tấm kim loại bằng vàng bị bám một lớp kim loại sắt ở bề mặt, để làm
sạch tấm kim loại vàng ta dùng:
A. Dung dịch CuSO4 dư ; C. Dung dịch ZnSO4 dư
B. Dung dịch FeSO4 dư ; D. Dung dịch H2SO4 loãng dư
Câu 12. Sự phá huỷ kim loại hay hợp kim do kim loại tác dụng trực tiếp với các chất
trong môi trường được gọi là
A. sự khử kim loại. C. sự ăn mòn hóa học.
B. sự tác dụng của kim loại với nước. D. sự ăn mòn điện hoá học.
Câu 13. Người ta căn cứ vào đâu để đánh giá mức độ hoạt động hoá học của phi
kim ?
A. Khả năng và mức độ phản ứng của phi kim đó với kim loại và oxi.
B. Khả năng và mức độ phản ứng của phi kim đó với phi kim và hiđro.
C. Khả năng và mức độ phản ứng của phi kim đó với hiđro và oxi.
D. Khả năng và mức độ phản ứng của phi kim đó với kim loại và hiđro
Câu 14. Ở điều kiện thường, phi kim ở thể lỏng là
A. oxi. ; B. brom. C. clo. ; D. cacbon.
Câu 15. Hàm lượng cacbon trong thép chiếm
A. trên 2%. ; B. từ 2% đến 5%. ; C. dưới 2% ; D. trên 5%.
B. TỰ LUẬN: (5 ĐIỂM)
Câu 1: (1đ)
Em hãy giải thích:
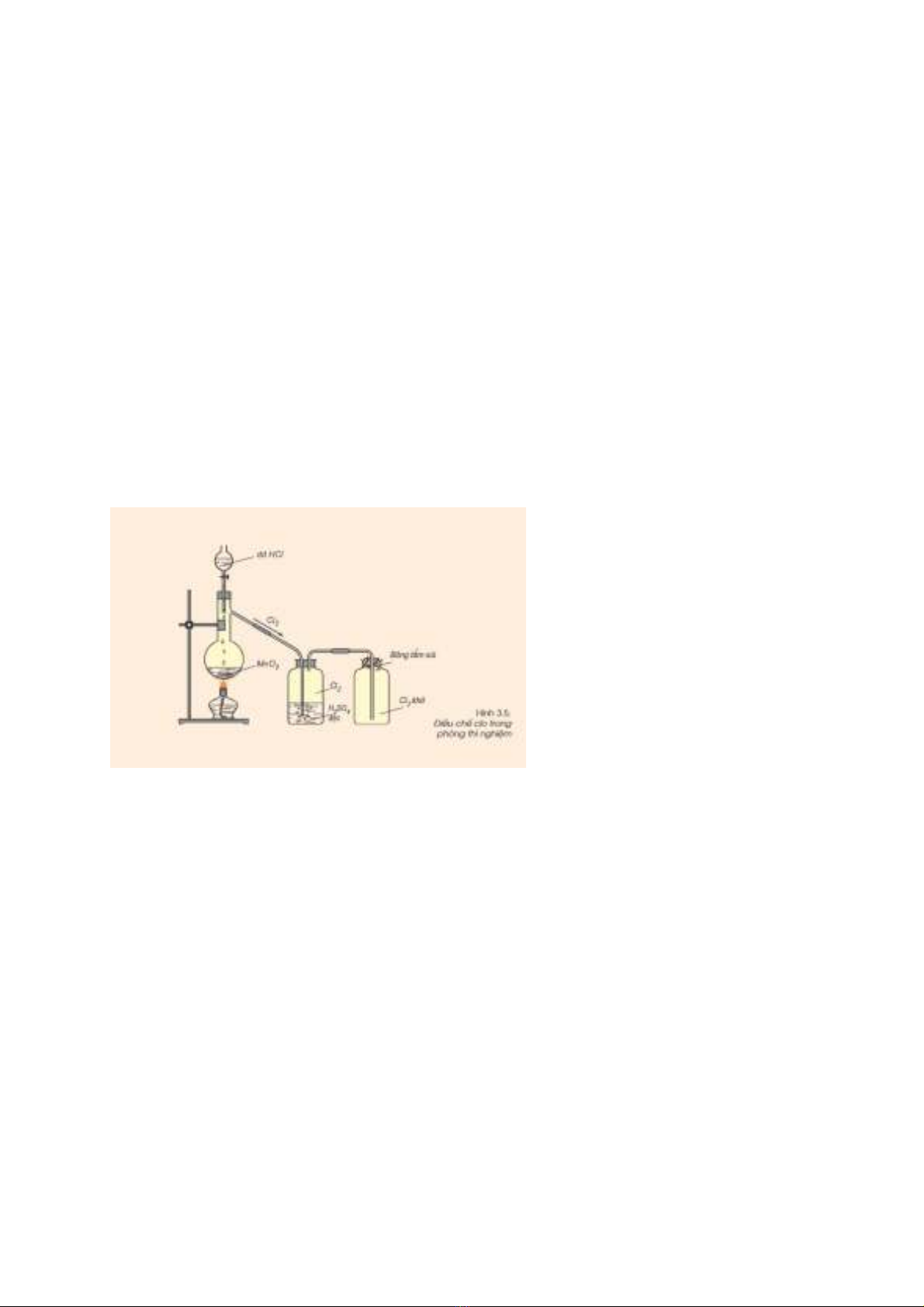
- Tại sao cần dẫn khí Clo vừa được điều chế qua bình đựng H2SO4 đặc?
- Tại sao khi thu khí Clo bằng cách đẩy không khí ta đặt ngửa bình thu và đặt
bông có tẩm xút (dung dịch NaOH) lên miệng bình đựng khí Clo? Viết phương trình
hóa học của phản ứng xảy ra.
Câu 2.(2đ):
a) (1đ) Hoàn thành các phương trình hóa học sau:
Al + HCl →
Fe + Cl2
b. (1đ) Có 3 lọ đựng riêng biệt đựng 3 kim loại : Na, Fe, Ag đã bị mất nhãn. Bằng
phương pháp hóa học hãy phân biệt ba kim loại 3 lọ trên. Viết phương trình hóa học của
phản ứng xảy ra.
Câu 3. (2,0 điểm) Cho 14,8 gam hỗn hợp X gồm Fe và Cu vào dung dịch H2SO4 20%
(loãng) vừa đủ, sau khi phản ứng hoàn toàn, thu được 3,36 lít khí hiđro (ở đk 0oC, 1 atm ).
a. Viết phương trình hóa học của phản ứng xảy ra.
b. Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp X.
c. Tính nồng độ phần trăm của dung dịch muối thu được sau phản ứng.

(Cho nguyên tử khối: Fe = 56, Cu = 64, S = 32, H=1, O=16.
Học sinh được sử dụng bảng hệ thống tuần hoàn các nguyên tố hóa học.)
--------- Hết---------
PHÒNG GD&ĐT TIÊN PHƯỚC
TRƯỜNG TH&THCS NGUYỄN DU
KIỂM TRA CUỐI KỲ I, NĂM HỌC 2023-
2024
Môn: HÓA HỌC – LỚP 9
HƯỚNG DẪN CHẤM
A. TRẮC NGHIỆM (5 ĐIỂM)
3 câu trả lời đúng đạt 1 điểm, 2 câu trả lời đúng đạt 0,7 điểm, 1 câu đúng đạt 0,3 điểm.
Câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
Đáp án C B B D A B B C C D D C D B C
B. TỰ LUẬN (5 ĐIỂM)
Câu 1: (1 điểm)
- Để thu khí Clo tinh khiết người ta cho khí Clo qua bình axit sulfuric đặc, nó sẽ được
làm khô nước.
- Thu khí Clo bằng phương pháp đẩy không khí ta đặt ngửa bình thu do khí Clo nặng
hơn không khí.
- Sử dụng bông tẩm xút (NaOH) để ở miệng bình thu nhằm để tránh khí Clo bay ra bên
ngoài vì Clo là khí độc.
- PTHH: Cl2 + 2NaOH → NaCl + NaClO + H2O
Câu 2: a) (1 điểm)
2Al + 6HCl → 2AlCl3 + 3H2 (0,5 điểm)
2Fe + 3Cl2 2FeCl3 (0,5 điểm)
b) (1đ) Trích mẫu thử và cho lần lượt các chất tác dụng với nước, mẫu thử nào tan trong
nước và sủi bọt khí đó là Na.
Hai mẫu thử còn lại không có hiện tượng là Fe và Ag. Để phân biệt hai kim loại này ta tiếp
tục trích mẫu thử và cho tác dụng lần lượt với HCl, chất có tác dụng với dung dịch HCl, tan
ra có bọt khí xuất hiện đó là Fe, chất còn lại không phản ứng với dung dịch HCl là Ag.
PTHH: 2Na + 2H2O → 2NaOH + H2
Fe + 2HCl → FeCl2 + H2
Câu 3 ( 2đ):
a. Chỉ có Fe phản ứng với dung dịch H2SO4 20%.
Fe + H2SO4 FeSO4 + H2 (0,25 điểm)
b. Số mol của H2: 0,15 mol (0,25 điểm)

Số mol của Fe: 0,15 mol
Khối lượng của Fe: 8,4 gam
% mFe = 56,76% (0,25 điểm)
%mCu = 43,24% (0,25 điểm)
c. Khối lượng H2SO4: 14,7 gam
Khối lượng dung dịch H2SO4 20%: 73,5 gam (0,25 điểm)
Khối lượng dung dịch sau phản ứng:
mdd (sau pư) = mFe + mddH2SO4 - mH2 = 8,4 + 73,5 - 0,3 = 81,6 (g) (0,25 điểm)
mFeSO4 = 22,8 (g) (0,25 điểm)
Nồng độ % của dung dịch muối sau phản ứng là:
C% ≈ 27,94 % (0,25 điểm)
(Lưu ý : HS có cách làm khác nhưng kết quả đúng vẫn cho điểm tối đa.)
Duyệt của trường Duyệt của tổ chuyên môn Giáo viên ra đề
Huỳnh Thị Thanh Yên

ĐÁP ÁN VÀ HƯỚNG DẪN CHẤM KIỂM TRA CUỐI HỌC KÌ 1
NĂM HỌC 2023 - 2024 . MÔN : HÓA HỌC 9
(Dành riêng cho HSKT)
C. TRẮC NGHIỆM (5 ĐIỂM)
3 câu trả lời đúng đạt 1 điểm, 2 câu trả lời đúng đạt 0,7 điểm, 1 câu đúng đạt 0,3 điểm.
Câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
Đáp án C B B D A B B C C D D C D B C
D. TỰ LUẬN (5 ĐIỂM)
Câu 1: (1 điểm)
- Để thu khí Clo tinh khiết người ta cho khí Clo qua bình axit sulfuric đặc, nó sẽ được
làm khô nước.
- Thu khí Clo bằng phương pháp đẩy không khí ta đặt ngửa bình thu do khí Clo nặng
hơn không khí.
- Sử dụng bông tẩm xút (NaOH) để ở miệng bình thu nhằm để tránh khí Clo bay ra bên
ngoài vì Clo là khí độc.
- PTHH: Cl2 + 2NaOH → NaCl + NaClO + H2O
Câu 2: ( 2 điểm)
2Al + 6HCl → 2AlCl3 + 3H2 (1 điểm)
2Fe + 3Cl2 2FeCl3 (1 điểm)
Câu 3 ( 2đ):
a. Chỉ có Fe phản ứng với dung dịch H2SO4 20%.
Fe + H2SO4 FeSO4 + H2 (0,5 điểm)
b. Số mol của H2: 0,15 mol (0,5 điểm)
Số mol của Fe: 0,15 mol
Khối lượng của Fe: 8,4 gam
% mFe = 56,76% (0,5 điểm)
%mCu = 43,24% (0,5 điểm)
(Không yêu cầu HSKT giải câu c)
(Lưu ý : HS có cách làm khác nhưng kết quả đúng vẫn cho điểm tối đa.)
Duyệt tổ CM Người ra đề


![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)




![Đề thi học kì 2 Vật lý lớp 11: Đề minh họa [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250709/linhnhil/135x160/711752026408.jpg)








