SỞ GIÁO DỤC VÀ ĐÀO TẠO
HÀ TĨNH
(Đề thi có 02 trang, gồm 8 câu)
KÌ THI CHỌN HỌC SINH GIỎI TỈNH LỚP 10,11 THPT
NĂM HỌC 2020-2021
Môn thi: HÓA HỌC-LỚP 10
Thời gian làm bài: 180 phút
Nguyên tử khối: H=1; C= 12; O =16; Mg =24; Al=27; S = 32; Cl = 35,5; Ca =40; Fe =56;Cu = 64;
Zn = 65; Br =79,9; Ag =108; I=127,1; Ba = 137; K = 39; N = 14.
Số hiệu nguyên tử của các nguyên tố:N(Z=7); O(Z=8); Na(Z=11), F(Z=9), Mg(Z=12), Al(Z=13),
Si(Z=14); P(Z=15); S(Z=16); Cl(Z=17);Ar(Z=18); K(Z=19); Ca(Z=20). Số Avogadro NA=6,022.1023.
Câu 1 (3,0 điểm)
1. Từ các đơn chất, viết 2 phương trình phản ứng tạo thành các hợp chất mà trong thành phần của nó chỉ
có những ion có cấu hình electron là 1s22s22p6.
2. Viết các phương trình phản ứng xảy ra trong các thí nghiệm được mô tả sau:
a) Hòa tan FeCl2 vào nước rồi thêm H2SO4 loãng dư, sau đó thêm dung dịch KMnO4 dư thấy có khí
màu vàng lục thoát ra và dung dịch thu được có chứa muối mangan (II).
b) Hòa tan Fe3O4 trong dung dịch H2SO4 đặc nóng dư được dung dịch A và khí B mùi hắc. Sục khí B
vào dung dịch brom hoặc dung dịch KMnO4 đều thấy các dung dịch này bị nhạt màu.
3. H2SO4 đặc có tính háo nước, nó có thể lấy nước từ một số hợp chất hữu cơ. Trong quá trình than hóa
saccarozơ có hình thành hỗn hợp khí A (gồm 2 khí).
a) Giải thích quá trình hình thành hỗn hợp khí A.
b) Trình bày phương pháp hóa học chứng minh sự có mặt của các khí trong A.
c) So sánh quá trình làm khô và quá trình than hóa của H2SO4 đặc.
Câu 2 (2,0 điểm)
Để hòa tan 9,2 gam hỗn hợp X gồm kim loại M và một oxit của M cần dùng vừa đủ 160 ml dung dịch
HCl 2M. Mặt khác, cho khí H2 dư đi qua 9,2 gam hỗn hợp X nung nóng, sau khi phản ứng xảy ra hoàn
toàn thì thu được 7,28 gam kim loại M. Xác định công thức phân tử của oxit trong hỗn hợp X.
Câu 3 (2,0 điểm)
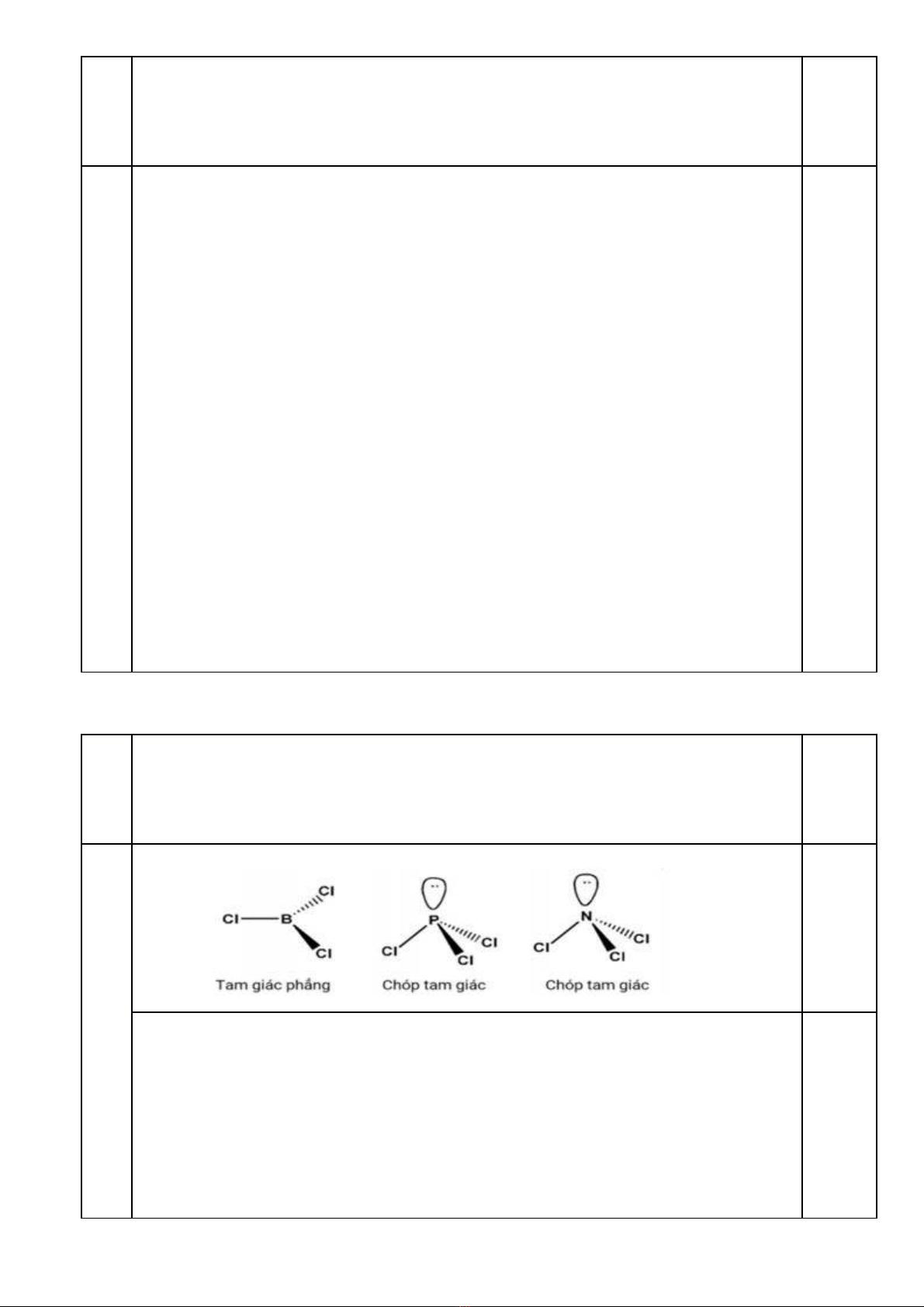
1. Vẽ cấu trúc hình học của các phân tử sau: BCl3, PCl3, NCl3 (biểu diễn cả các cặp electron hóa trị
không tham gia liên kết của nguyên tử trung tâm, nếu có).
2. So sánh và giải thích góc liên kết ClXCl (X là B, P, N) của các phân tử BCl3, PCl3 và NCl3.
3. Giải thích tại sao trong pha khí, phân tử PBr5 kém bền hơn PCl5.
4. Khi ngưng tụ hơi PCl5 thu được pha rắn là hợp chất ion [PCl4]+[PCl6]-. Vẽ cấu trúc hình học của các
ion [PCl4]+ và [PCl6]-
Câu 4 (2,0 điểm)
1. Cho m gam hợp chất X (được tạo thành từ hai nguyên tố) phản ứng hoàn toàn với H2SO4 đặc, nóng
chỉ thu được H2O và 10,08 lít (đktc) hỗn hợp khí A gồm hai khí. A làm mất màu vừa đủ 0,8 lít dung dịch
Br2 0,5M trong nước và A không có phản ứng với dung dịch CuCl2. Cho A vào dung dịch Ca(OH)2 dư,
thu được 53 gam kết tủa trắng. Xác định công thức của X và tính m.
2. Vẽ giản đồ quan hệ giữa năng lượng ion hóa thứ ba (I3) theo số hiệu nguyên tử của các nguyên tố chu
kỳ ba từ Na đến Ar. Giải thích giản đồ đã vẽ.
Câu 5 (2,0 điểm)
Đốt cháy hỗn hợp gồm 1,3 gam Zn và 1,12 gam Fe với hỗn hợp khí X gồm clo và oxi, sau phản ứng
chỉ thu được hỗn hợp Y gồm các oxit và muối clorua (không còn khí dư). Hòa tan Y bằng một lượng
vừa đủ 60 ml dung dịch HCl 1M, thu được dung dịch Z. Cho AgNO3 dư vào dung dịch Z, thu được
13,995 gam kết tủa. Tính phần trăm thể tích của mỗi khí trong hỗn hợp X.
Câu 6 (3,0 điểm)
1. Cho 0,36 gam một đơn chất R (chất rắn ở điều kiện thường, có thể tồn tại dạng đơn chất trong tự
nhiên) tác dụng với lượng dư dung dịch H2SO4 đặc thu được khí X. Thu toàn bộ khí X vào dung dịch
nước vôi dư thì nhận được 10,2 gam kết tủa. Xác định đơn chất R.
1