
Ch¬ng IV: HÖ mét electron mét h¹t nh©n
Mét sè kh¸I niÖm c¬ b¶n
9(6, 3)
Ngµy so¹n: 20/10/08
Ngµy gi¶ng: 24/10/08
I. Môc tiªu:
Sau khi häc xong ch¬ng nµy cÇn n¾m ®îc:
1. KiÕn thøc
- HÖ mét h¹t nh©n, mét electron: hµm riªng, trÞ riªng
- Kh¸i niÖm AO nguyªn tö vµ c¸c vÊn ®Ò liªn quan
- Hµm mËt ®é x¸c suÊt , m©y electron, c¸ch biÓu diÔn h×nh ¶nh AO
- Spin electron, hµm sãng toµn phÇn m« t¶ tr¹ng th¸i 1 electron
- Bé bèn sè lîng tö
- Quang phæ v¹ch hi®ro
2. KÜ n¨ng
- Gi¶i ph¬ng tr×nh Sro®ing¬( ph¬ng tr×nh hµm riªng trÞ riªng)
- BiÓu diÔn ®îc hµm sãng ®Çy ®ñ
- BiÓu diÔn h×nh ¶nh m©y electron
3. Th¸i ®é t×nh c¶m
- ThÊy ®îc sù ph¸t triÓn cña c¸c thuyÕt ho¸ häc
- Lßng ham mª khoa häc, yªu thÝch bé m«n ho¸ häc
II. Ph¬ng ph¸p
- Ph¬ng ph¸p d¹y häc nªu vÊn ®Ò
- Ph¬ng ph¸p ®µm tho¹i gîi më
- Ph¬ng ph¸p thuyÕt tr×nh, kÌm theo gi¶i thÝch minh ho¹
- Ph¬ng ph¸p luyÖn tËp
III. ChuÈn bÞ:
- GV: Gi¸o ¸n, gi¸o tr×nh
- SV: bµi chuÈn bÞ, gi¸o tr×nh
IV. Néi dung

Ho¹t ®éng Néi dung
- HÖ to¹ ®é §ecac?
Bµi 1: Më ®Çu
I. HÖ to¹ ®é cÇu
1. HÖ to¹ ®é §ecac
- Ba trôc Ox, Oy, Oz øng víi c¸c biÕn sè x, y, z
2. HÖ to¹ ®é cÇu
- Cã 3 biÕn sè
, , r
θ ϕ
r
Gãc
θ
: t¹o bëi Oz víi vÞ trÝ
r
;
θ
: gãc kinh
tuyÕn
Gãc
ϕ
: t¹o bëi Ox vµ h×nh chiÕu cña
r
r
xuèng
mÆt ph¼ng xOy;
ϕ
: gãc vÜ tuyÕn
§é dµi vect¬
r
r
:
r r=r
- TrÞ sè: 0 <
θ
<
π
; 0 <
ϕ
< 2
π
; 0< r <
3. Mèi liªn hÖ
sin
sin
x r cos
y r sin
z rcos
θ ϕ
θ ϕ
θ
=
=
=
II. Trêng lùc ®èi xøng xuyªn t©m
1. Kh¸i niÖm
- Trêng lùc ®îc gäi lµ trêng lùc ®èi xøng xuyªn
t©m hay chÝnh t¸c nÕu lùc t¸c dông vµo mét
vËt chuyÓn ®éng trong trêng ®ã ®i qua mét
®iÓm cè ®Þnh ®îc chän lµm t©m cña trêng vµ
®é lín cña lùc t¸c dông chØ phô thuéc vµo
kho¶ng c¸ch tõ vÞ trÝ cña vËt ®Õn ®Õn t©m
cña trêng chø kh«ng phô thuéc vµo ph¬ng.
ThÕ n¨ng chØ lµ hµm cña
r
r
; U = U(r)
2. §Þnh luËt b¶o toµn
a. N¨ng lîng: E = T+U = const
b. Vect¬ momen ®éng lîng
M
uur

Ho¹t ®éng: Nguyªn tè hay ion
nµo cã d¹ng 1 e, 1 h¹t nh©n?
- Nguyªn tö hi®ro, ion: He+,
Li2+, Be3+
? Víi nguyªn tö hi®ro th×
mb»ng bao nhiªu , biÕt mhn=
1836me
.M r p const
� �
= =
� �
uur r ur
Bµi 2: HÖ mét electron , mét h¹t nh©n
S¬ ®å:
§©y chÝnh lµ m« h×nh trêng lùc ®èi xøng
xuyªn t©m . BiÓu thøc tÝnh thÕ n¨ng cña e :
2
0
( ) Ze
U U r r
= = −
; e0: ®iÖn tÝch nguyªn tè
VËy thùc chÊt cña hÖ lîng tö nµy lµ xÐt mét
electron chuyÓn ®éng trong trêng lùc h¹t nh©n
cã ®iÖn tÝch d¬ng Ze0.
I. S¬ lîc vÒ lêi gi¶i ph¬ng tr×nh Sro®ing¬
cho hÖ mét h¹t nh©n mét electron
ᄉ
H E
ψ ψ
=
Mµ
ᄉ
ᄉ
ᄉ
2
2 2 2 2
0
2 2 2
2
Ze
d d d
H T U m dx dy dz r
� �
= + = − + + −
� �
� �
h
Trong hÖ to¹ ®é cÇu:
ᄉ
2
2
2 2
2
2 2
1.
2
1 1
. sin .
sin sin
d d
H r U
m r dr dr r
d d d
d d d
θ
θ θ θ θ ϕ
Λ� �
� �
= − + +
� �
� �
� �
� �
� �
Λ = +
� �
� �
h
HÖ 2 h¹t : h¹t nh©n khèi lîng m1, electron
khèi lîng m2. VËy khèi lîng trong biÓu thøc trªn
lµ khèi lîng rót gän: m = m1.m2/(m1+m2)
- Hµm sãng
( )
r
ψ
r
m« t¶ tr¹ng th¸i chuyÓn ®éng
cña electron trong trêng lùc ®èi xøng xuyªn
t©m:
( ) ( )
( )
. ,r R r Y
ψ θ ϕ
=
r r
R(r): Hµm b¸n kÝnh hay phÇn xuyªn t©m
Y(
,
θ ϕ
): Hµm gãc hay hµm cÇu
VËy ph¬ng tr×nh Sro®ing¬:

Víi mçi gi¸ trÞ cña n cã bao
nhiªu gi¸ trÞ l vµ ml?
VD: Cho biÕt Z =1 . TÝnh E1,
E2, E3 theo:
a. HÖ ®¬n vÞ nguyªn tö
b. HÖ ®¬n vÞ eV
c. NhËn xÐt khi nµo E
min?
ᄉ
( ). ( , ) ( ). ( , )HR r Y ER r Y
θ ϕ θ ϕ
=
(4)
Dïng phÐp vi ph©n biÕn sè víi to¸n tö
Hamint¬n
(4):
( )
( )
2 2
2
2
2
r
r mr Y
R E U r
R Y
Λ
+ − = −� � �
� �
h
(5)
2
2 2
2 2
1 2
. .
r
d d d d
r
r dr dr dr r dr
� �
= = +�� �
� �
XÐt ph¬ng tr×nh (5):
vÕ tr¸i phô thuéc vµo r
vÕ ph¶i phô thuéc vµo gãc
Tõ ®ã VT= VP= const
Hay:
( )
[ ]
2 2
2
2
2( ) ;
0
r
r mr
R E U r
R
YY Y
Y
λ
λ λ
+ − =�
Λ= Λ + =
h
1. TrÞ riªng
- Khi gi¶i ph¬ng tr×nh gãc ( ph¬ng tr×nh hµm
riªng trÞ riªng cña
Z
M
uuur
vµ
ᄉ
z
M
uuur
) thu ®îc trÞ riªng
m
h
vµ l(l + 1)
h
2
VÒ mÆt to¸n häc l, m tho¶ m·n:
l = 1, 2, 3, 4,…(n-1) ( l: sè lîng tö phô)
ml= 0,
1,
2,…,
(n-1) ( ml: sè lîng tñ tõ AO)
- Khi gi¶i ph¬ng tr×nh b¸n kÝnh thu ®îc n, sè l-
îng tö chÝnh
n = 0, 1, 2, …, nguyªn
2 4
0
2 2
2
mZ e
En
= − h
m: khèi lîng mét e
e0: ®iÖn tÝch c¬ së
Z: ®iÖn tÝch h¹t nh©n
- Khi Z cè ®Þnh, En ®¹t cùc tiÓu nÕu n thÊp
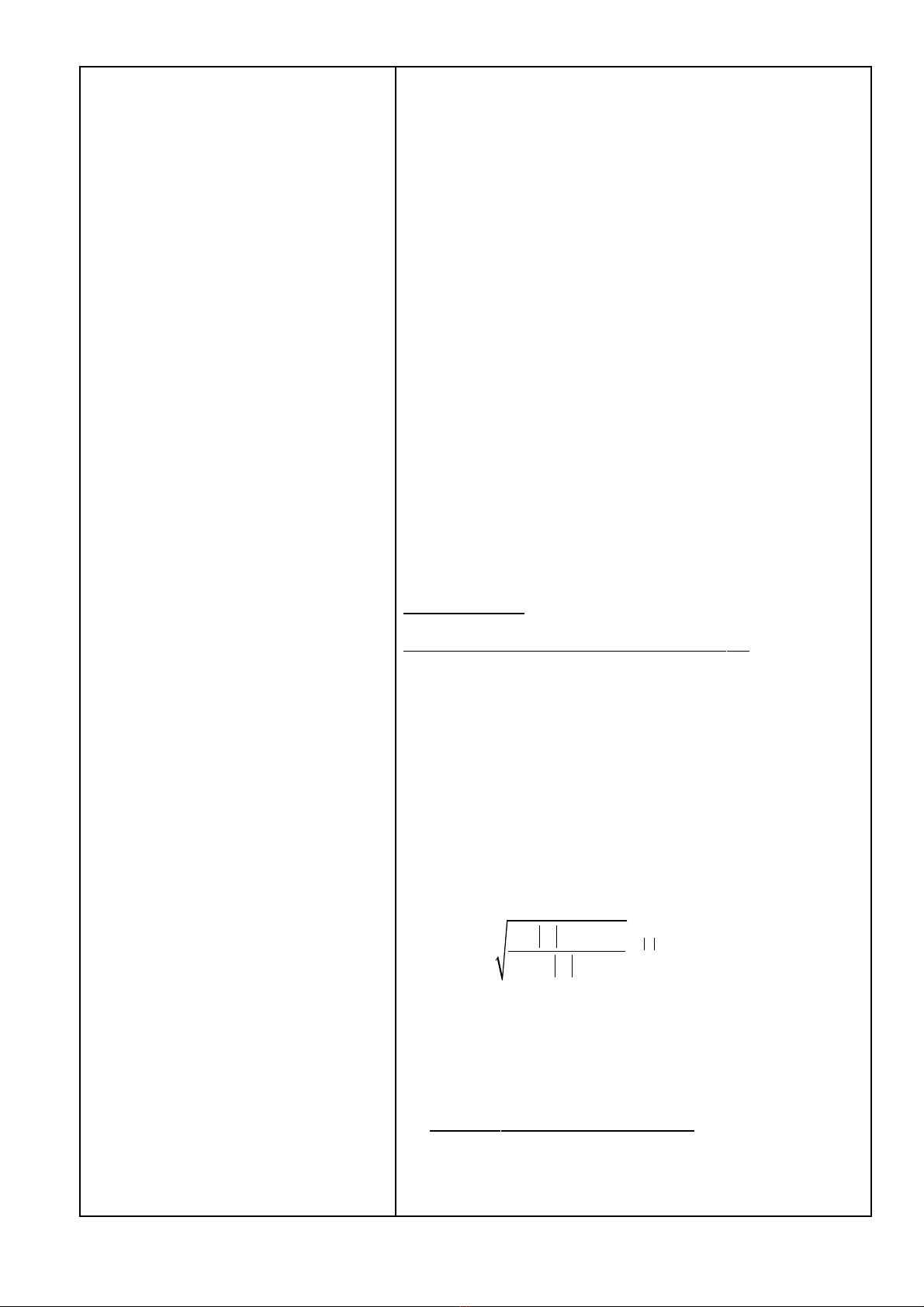
- BiÕt líp electron M øng víi n
=3. H·y:
a. TÝnh c¸c sè lîng tö l, ml cã
thÓ cã víi líp M
nhÊt. Khi n cè ®Þnh, En cµng thÊp nÕu Z cµng
lín
- Tr¹ng th¸i mµ hÖ lîng tö cã n¨ng lîng thÊp
nhÊt lµ tr¹ng th¸i c¬ b¶n
- Cïng trÞ riªng n¨ng lîng En, ta cã bé ba sè lîng
tö lµ n, l, ml.
- Sè lîng tö chÝnh n: sè líp hay sè thø tù cña
chu kú
n =1 2 3 4 5
Líp K M N O P
Chu kú:1 2 3 4 5
- TrÞ sè l dïng ®Ó chØ ph©n líp
TrÞ sè cña l: 0 1 2 3 4
Ph©n líp: s p d f g
2. Hµm riªng
a. Khi gi¶i ph ¬ng tr×nh gãc, thu ® îc:
- Hµm riªng cña
ᄉ
z
M
lµ
( )
φ ϕ
tØ lÖ víi
im
e
ϕ
hay
( )
.
im
A e
ϕ
φϕ
=
e = 2,72183
i: ®¬n vÞ ¶o
ϕ
: gãc vÜ tuyÕn
- Hµm riªng cña
ᄉ
2
z
M
uur
cã d¹ng:
( )
( )
( )
, 1
1 ! 2 1 . .cos .
1 !4
l
mim
l m
m l
Y P e
m
ϕ
θ
π
− +
=+
Y liªn hÖ víi 2 biÕn sè gãc:
θ
,
ϕ
Yl, ml: hµm cÇu lµ hµm chuÈn ho¸, tho¶ m·n c¸c
®iÒu kiÖn cña hµm sãng
b. Gi¶i ph ¬ng tr×nh b¸n kÝnh (TrÞ riªng En, n)
ta thu ®îc hµm riªng Rn,l(r)




![Bài tập so sánh hơn và so sánh nhất của tính từ [kèm đáp án/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250808/nhatlinhluong27@gmail.com/135x160/77671754900604.jpg)
![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)




![Tài liệu Lý thuyết và Bài tập Tiếng Anh lớp 6 [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250802/hoihoangdang@gmail.com/135x160/18041754292798.jpg)





