1
SỞ GIÁO DỤC VÀ ðÀO TẠO
THÀNH PHỐ ðÀ NẴNG HƯỚNG DẪN CHẤM KÌ THI HỌC SINH GIỎI THÀNH PHỐ
NĂM HỌC 2004 - 2005
MÔN: HÓA HỌC LỚP 10
Thời gian: 150 phút (không kể thời gian giao ñề)
Câu I (4 ñiểm)
1. Nguyên tử của nguyên tố X có ñiện tích hạt nhân bằng +41,652.10
-19
C; nguyên tử của nguyên tố Y
có khối lượng bằng 1,8.10
-22
gam. Xác ñịnh X, Y và dựa trên cấu hình electron, hãy cho biết (có
giải thích) mức oxi hóa bền nhất của X và Y trong hợp chất.
2. (a) Hãy cho biết (có giải thích) theo thuyết liên kết hóa trị thì lưu huỳnh (S) có thể có cộng hóa trị
bằng bao nhiêu?
(b) Cho biết cấu tạo ñơn phân tử và dạng hình học của hợp chất với hiñro, oxit và hiñroxit của lưu
huỳnh tương ứng với các giá trị cộng hóa trị ñã xác ñịnh ở câu (a).
3. Năng lượng ion hóa thứ nhất (I
1
- kJ/mol) của các nguyên tố chu kỳ 2 có giá trị (không theo trật tự)
1402, 1314, 520, 899, 2081, 801, 1086, 1681. Gán các giá trị này cho các nguyên tố tương ứng.
Giải thích.
ðÁP ÁN ðIỂM
1.
26
10.602,1
10.652,41
Z
19
19
X
==
−
−
, X là sắt (Fe);
u108
10.6605,1
10.793,1
m
24
22
Y
==
−
−
, Y là bạc (Ag)
Mức oxi hóa bền nhất của Fe là +3, ứng với cấu hình bền là cấu hình bán bão hòa phân
lớp d (d
5
):
526
r)3d(A
3
s4d3)Ar(
Fee3Fe
+
→−
Mức oxi hóa bền nhất của Ag là +1, ứng với cấu hình bền là cấu hình bão hòa phân lớp
d (d
10
):
10110
r)4d(A s5d4)Kr(
gAeAg
+
→−
1,00
2.
(a) C
ộ
ng hóa tr
ị
c
ủ
a m
ộ
t nguyên t
ố
b
ằ
ng
số liên kết mà nguyên tử nguyên tố ñó tạo ra
ñược với các nguyên tử khác trong phân tử
. Trong thuy
ế
t liên k
ế
t hóa tr
ị
, m
ỗ
i liên k
ế
t
c
ộ
ng hóa tr
ị
l
ạ
i
ñượ
c hình thành do s
ự
xen ph
ủ
các obitan mang electron
ñộ
c thân. Nh
ư
v
ậ
y có th
ể
nói r
ằ
ng
cộng hóa trị của một nguyên tố bằng số electron ñộc thân có thể có
của nguyên tử của nguyên tố ñó
. Vì có th
ể
có 2, 4 ho
ặ
c 6 electron
ñộ
c thân nên l
ư
u
hu
ỳ
nh có th
ể
có
cộng hóa trị bằng 2, 4, hoặc 6
:
16
S3s 3p 3d
16
S
*
3s 3p 3d
16
S
*
3s 3p 3d
1,00
(b) C
ấ
u t
ạ
o và d
ạ
ng hình h
ọ
c:
H2S
S
H H
ch÷ V
SO2
S
O O
ch÷ V
SO3
S
O O
tam gi¸c
O
H2SO4
S
HO O
tø diÖn
OH
O
1,00

2
3. Giá tr
ị
n
ă
ng l
ượ
ng ion hóa t
ươ
ng
ứ
ng v
ớ
i các nguyên t
ố
:
IA IIA IIIA
IVA VA VIA VIIA
VIIIA
Li Be B C N O F Ne
2s
1
2s
2
2p
1
2p
2
2p
3
2p
4
2p
5
2p
6
I
1
(kJ/mol)
520
899
801 1086
1402
1314
1681 2081
Nhìn chung t
ừ
trái qua ph
ả
i trong m
ộ
t chu k
ỳ
n
ă
ng l
ượ
ng ion hóa I
1
t
ă
ng d
ầ
n, phù h
ợ
p
v
ớ
i s
ự
bi
ế
n thiên nh
ỏ
d
ầ
n c
ủ
a bán kính nguyên t
ử
.
Có hai bi
ế
n thiên b
ấ
t th
ườ
ng x
ả
y ra
ở
ñ
ây là:
- T
ừ
IIA qua IIIA, n
ă
ng l
ượ
ng I
1
gi
ả
m do có s
ự
chuy
ể
n t
ừ
c
ấ
u hình b
ề
n
ns
2
qua c
ấ
u hình
kém b
ề
n h
ơ
n
ns
2
np
1
(electron p ch
ị
u
ả
nh h
ưở
ng ch
ắ
n c
ủ
a các electron s nên liên k
ế
t v
ớ
i
h
ạ
t nhân kém b
ề
n ch
ặ
t h
ơ
n).
- T
ừ
VA qua VIA, n
ă
ng l
ượ
ng I
1
gi
ả
m do có s
ự
chuy
ể
n t
ừ
c
ấ
u hình b
ề
n
ns
2
np
3
qua c
ấ
u
hình kém b
ề
n h
ơ
n
ns
2
np
4
(trong p
3
ch
ỉ
có các electron
ñộ
c thân, p
4
có m
ộ
t c
ặ
p ghép
ñ
ôi,
xu
ấ
t hi
ệ
n l
ự
c
ñẩ
y gi
ữ
a các electron).
1,00
Câu II
(4
ñ
i
ể
m)
1. Tính nhi
ệ
t hình thành c
ủ
a ion clorua (Cl
-
) d
ự
a trên các d
ữ
li
ệ
u:
Nhi
ệ
t hình thành HCl (k): 2,92H
o
1
−=∆
kJ/mol
Nhi
ệ
t hình thành ion hidro (H
+
): 0H
o
2
=∆
kJ/mol
HCl (k) + aq
→
H
+
(aq) + Cl
-
(aq)
13,75H
o
3
−=∆ kJ/mol
2.
Khí SO
3
ñượ
c t
ổ
ng h
ợ
p trong công nghi
ệ
p theo ph
ả
n
ứ
ng:
SO
2
(k) + 1/2O
2
(k)
SO
3
(k)
=
∆
H
-192,5 kJ
ðề
ngh
ị
các bi
ệ
n pháp làm t
ă
ng hi
ệ
u su
ấ
t quá trình t
ổ
ng h
ợ
p SO
3
.
3.
Cho cân b
ằ
ng hóa h
ọ
c sau: N
2
O
4
(k)
⇌
2NO
2
(k) (1)
Th
ự
c nghi
ệ
m cho bi
ế
t kh
ố
i l
ượ
ng mol phân t
ử
trung bình c
ủ
a hai khí trên
ở
35
o
C b
ằ
ng 72,45 g/mol
và
ở
45
o
C b
ằ
ng 66,80 g/mol.
(a)
Tính
ñộ
phân li c
ủ
a N
2
O
4
ở
m
ỗ
i nhi
ệ
t
ñộ
trên?
(b)
Tính h
ằ
ng s
ố
cân b
ằ
ng K
P
c
ủ
a (1)
ở
m
ỗ
i nhi
ệ
t
ñộ
trên? Bi
ế
t P = 1 atm
(c)
Cho bi
ế
t theo chi
ề
u ngh
ị
ch, ph
ả
n
ứ
ng thu nhi
ệ
t hay t
ỏ
a nhi
ệ
t?
ðÁP ÁN ðIỂM
1.
T
ừ
gi
ả
thi
ế
t:
2
1H
2
(k) +
2
1Cl
2
(k)
→
HCl (k) 2,92Ho
1
−=∆
kJ/mol (1)
2
1H
2
(k) + aq
→
H
+
(aq) + e 0Ho
2
=∆
kJ/mol (2)
HCl (k) + aq
→
H
+
(aq) + Cl
-
(aq) 13,75Ho
3
−=∆
kJ/mol (3)
L
ấ
y (1) - (2) + (3) ta có:
2
1Cl
2
(k) + aq + e
→
Cl
-
(aq) o
x
H
∆
kJ/mol
=−+−−=∆ )mol/kJ13,75()mol/kJ0()mol/kJ2,92(H
o
x
-167,33 kJ/mol
1,00
2.
- (T
ă
ng áp su
ấ
t),
- h
ạ
nhi
ệ
t
ñộ
(450
o
C có xúc tác V
2
O
5
),
- (t
ă
ng n
ồ
ng
ñộ
SO
2
ho
ặ
c O
2
),
- gi
ả
m n
ồ
ng
ñộ
SO
3
.
1,00

3
3.
Xét cân b
ằ
ng: N
2
O
4
(k)
⇌
2NO
2
(k) (1)
(a)
G
ọ
i a là s
ố
mol c
ủ
a N
2
O
4
có trong 1 mol h
ỗ
n h
ợ
p
⇒
s
ố
mol NO
2
trong 1 mol h
ỗ
n
h
ợ
p là (1 - a) mol
Ở
35
0
C có
M
= 72,45 g/mol = 92a + 46(1 - a)
⇒
a = 0,575 mol = nN
2
O
4
và nNO
2
= 0,425 mol
N
2
O
4
(k)
⇌
2NO
2
(k)
Ban
ñầ
u x 0
Ph
ả
n
ứ
ng 0,2125 0,425
Cân b
ằ
ng x - 0,2125 0,425
x - 0,2125 = 0,575
⇒
x = 0,7875 mol , v
ậ
y
=×=α
%100
7875,0
2125,0
26,98%
0,50
Ở
45
0
C có
M
= 66,80 g/mol = 92a + 46(1 - a)
⇒
a = 0,4521mol = nN
2
O
4
và nNO
2
= 0,5479 mol
N
2
O
4(k)
⇌
2NO
2(k)
Ban
ñầ
u x 0
Ph
ả
n
ứ
ng 0,27395 0,5479
Cân b
ằ
ng x - 0,27395 0,5479
x - 0,27395 = 0,4521
⇒
x = 0,72605 mol , v
ậ
y
=×=α
%100
72605,0
27395,0
37,73%
0,50
(b)
P
n
n
P
hh
NO
NO
2
2
=, P
n
n
P
hh
ON
ON
42
42
= và P = 1 atm
Ở
35
0
C === 575,0
)425,0(
P
)P(
K
2
ON
2
NO
P
42
2
0,314
Ở
45
0
C === 4521,0
)5479,0(
P
)P(
K
2
ON
2
NO
P
42
2
0,664
0,50
(c)
T
ừ
k
ế
t qu
ả
th
ự
c nghi
ệ
m ta th
ấ
y, khi nhi
ệ
t
ñộ
t
ă
ng t
ừ
35
0
C lên 45
0
C thì
α
t
ă
ng. Có
ngh
ĩ
a khi nhi
ệ
t
ñộ
t
ă
ng cân b
ằ
ng d
ị
ch chuy
ể
n theo chi
ề
u thu
ậ
n. V
ậ
y theo chi
ề
u
thu
ậ
n ph
ả
n
ứ
ng thu nhi
ệ
t, nên theo chi
ề
u ngh
ị
ch ph
ả
n
ứ
ng
tỏa nhiệt
.
0,50
Câu III
(4
ñ
i
ể
m)
1.
S
ụ
c khí clo qua dung d
ị
ch kali iotua m
ộ
t th
ờ
i gian dài, sau
ñ
ó ng
ườ
i ta cho h
ồ
tinh b
ộ
t vào thì
không th
ấ
y xu
ấ
t hi
ệ
n màu xanh. Hãy gi
ả
i thích và vi
ế
t ph
ươ
ng trình hoá h
ọ
c minh h
ọ
a.
2.
ðể
nh
ậ
n bi
ế
t ion sunfit, ng
ườ
i ta cho vào m
ộ
t
ố
ng nghi
ệ
m 1
ñế
n 2 gi
ọ
t dung d
ị
ch iot, 3
ñế
n 4 gi
ọ
t
dung d
ị
ch A có ch
ứ
a ion sunfit (1). Sau
ñ
ó cho ti
ế
p vào
ñ
ó 2-3 gi
ọ
t dung d
ị
ch HCl và vài gi
ọ
t dung
d
ị
ch BaCl
2
th
ấ
y xu
ấ
t hi
ệ
n k
ế
t t
ủ
a B (2).
(a)
Nêu hi
ệ
n t
ượ
ng x
ả
y ra trong các giai
ñ
o
ạ
n 1, 2 c
ủ
a thí nghi
ệ
m và vi
ế
t ph
ươ
ng trình hóa h
ọ
c
ñể
minh h
ọ
a.
(b)
Cho bi
ế
t t
ạ
i sao thí nghi
ệ
m nh
ậ
n bi
ế
t ion sunfit nêu trên th
ườ
ng
ñượ
c ti
ế
n hành trong môi
tr
ườ
ng axit ho
ặ
c môi tr
ườ
ng trung hòa, không
ñượ
c ti
ế
n hành trong môi tr
ườ
ng baz
ơ
?
3.
Hòa tan 8,4 gam kim lo
ạ
i M b
ằ
ng dung d
ị
ch H
2
SO
4
ñặ
c nóng d
ư
, hay hòa tan 52,2 gam mu
ố
i
cacbonat kim lo
ạ
i này c
ũ
ng trong dung d
ị
ch H
2
SO
4
ñặ
c nóng d
ư
, thì l
ượ
ng khí sinh ra
ñề
u làm m
ấ
t
màu cùng m
ộ
t l
ượ
ng brom trong dung d
ị
ch. Vi
ế
t các ph
ươ
ng trình hoá h
ọ
c và xác
ñị
nh kim lo
ạ
i M,
công th
ứ
c phân t
ử
mu
ố
i cacbonat.

4
ðÁP ÁN ðIỂM
1.
2KI + Cl
2
→
I
2
+ 2KCl
Sau m
ộ
t th
ờ
i gian có x
ả
y ra ph
ả
n
ứ
ng:
I
2
+ 5Cl
2
+ 6H
2
O
→
2HIO
3
+ 10HCl
Sau ph
ả
n
ứ
ng không có I
2
t
ự
do nên h
ồ
tinh b
ộ
t không chuy
ể
n sang màu xanh
1,00
2.
(a)
Ở
giai
ñ
o
ạ
n (1)
màu ñỏ nâu của dung dịch iot sẽ nhạt dần
do x
ả
y ra s
ự
oxi hoá ion
sunfit thành ion sunfat theo ph
ươ
ng trình:
SO
32-
+ I
2
+ H
2
O → SO
42-
+ 2H
+
+ 2I
-
Ở
giai
ñ
oan (2)
xuất hiện kết tủa màu trắng
do s
ự
hình thành k
ế
t t
ủ
a BaSO
4
không tan
trong axit:
SO
42-
+ Ba
2+
→ BaSO
4
↓
1,00
(b) Không th
ự
c hi
ệ
n trong môi tr
ườ
ng ki
ề
m vì trong môi tr
ườ
ng ki
ề
m s
ẽ
x
ả
y ra ph
ả
n
ứ
ng t
ự
oxi hoá kh
ử
c
ủ
a I
2
: 3I
2
+ 6OH
-
→ 5I
-
+ IO
3-
+ 3H
2
O
0,50
3.
Các ph
ươ
ng trình ph
ả
n
ứ
ng:
2M + 2mH
2
SO
4
→ M
2
(SO
4
)
m
+ mSO
2
+ 2mH
2
O (1)
M
2
(CO
3
)
n
+ (2m-n)H
2
SO
4
→ M
2
(SO
4
)
m
+ (m-n) SO
2
+ nCO
2
+ (2m-n)H
2
O (2)
SO
2
+ Br
2
+ 2H
2
O → H
2
SO
4
+ 2HBr (3)
1,25
Theo gi
ả
thi
ế
t
)2(SO)1(SO
22
nn
=
⇔ )nm(
n
60
M
2
2,52
2
m
M
4,8
−×
+
=×
⇒
n2,52m8,43
mn252
M
−
=
n = 1, m = 2
⇒
M = 14,23 (lo
ạ
i)
n = 1, m = 3
⇒
M = 9,5 (lo
ạ
i)
n = 2, m = 3
⇒
M = 56 (h
ợ
p lý)
V
ậ
y M là Fe và công th
ứ
c mu
ố
i là FeCO
3
.
0,75
Câu IV
(4
ñ
i
ể
m)
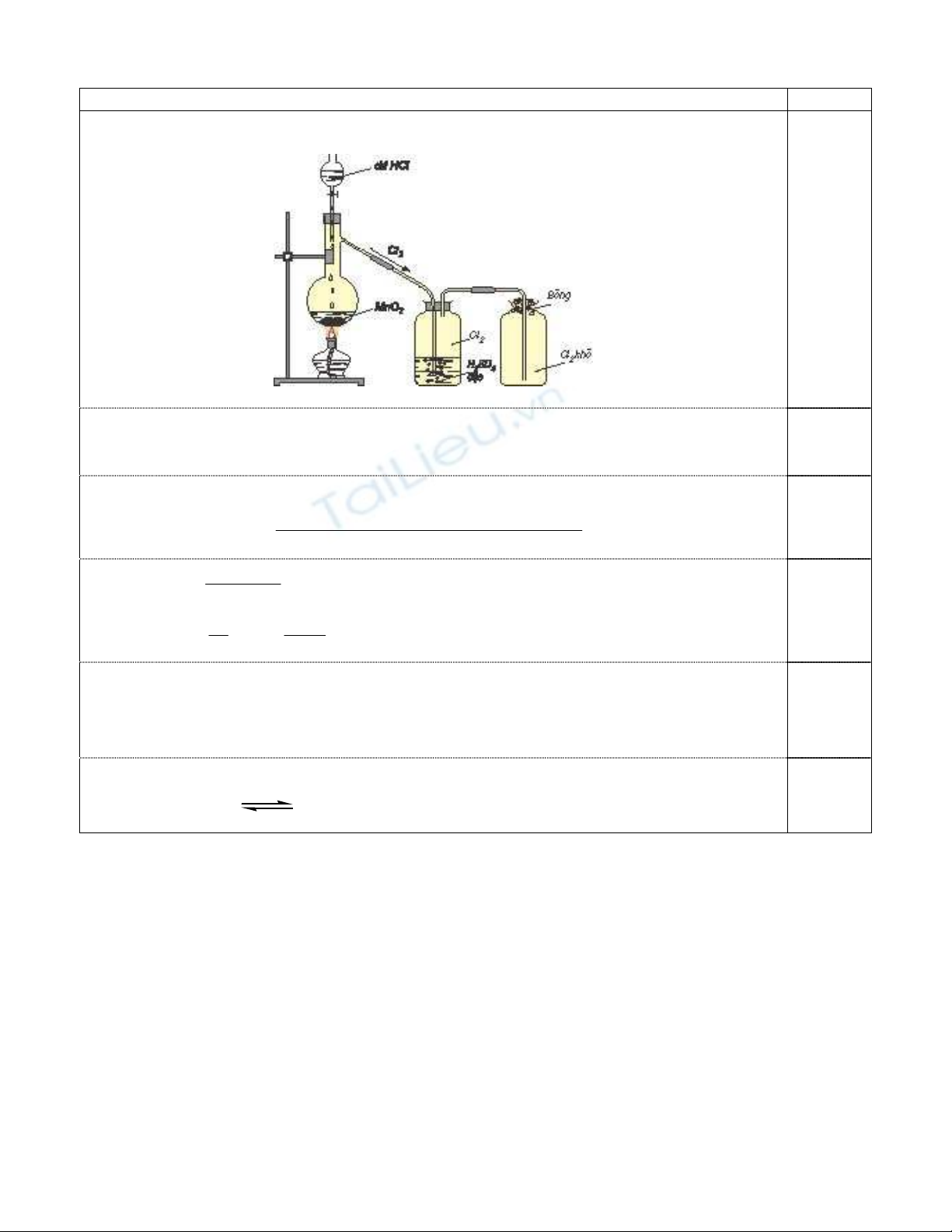
1.
V
ẽ
hình (có chú thích
ñầ
y
ñủ
) mô t
ả
thí nghi
ệ
m
ñ
i
ề
u ch
ế
Cl
2
khô t
ừ
MnO
2
và dung d
ị
ch HCl.
2.
Kali clorat
ñượ
c s
ử
d
ụ
ng trong các ngành s
ả
n xu
ấ
t diêm, pháo hoa và ch
ấ
t n
ổ
. Trong công nghi
ệ
p,
kali clorat
ñượ
c
ñ
i
ề
u ch
ế
b
ằ
ng cách cho khí clo
ñ
i qua n
ướ
c vôi
ñ
un nóng, r
ồ
i l
ấ
y dung d
ị
ch nóng
ñ
ó tr
ộ
n v
ớ
i KCl và
ñể
ngu
ộ
i
ñể
cho kali clorat k
ế
t tinh (ph
ươ
ng pháp 1). Kali clorat còn
ñượ
c
ñ
i
ề
u
ch
ế
b
ằ
ng cách
ñ
i
ệ
n phân dung d
ị
ch KCl 25%
ở
nhi
ệ
t
ñộ
70
ñế
n 75
o
C (ph
ươ
ng pháp 2).
(a)
Vi
ế
t ph
ươ
ng trình hóa h
ọ
c x
ả
y ra trong m
ỗ
i ph
ươ
ng pháp
ñ
i
ề
u ch
ế
kali clorat.
(b)
Tính kh
ố
i l
ượ
ng kali clorua và
ñ
i
ệ
n l
ượ
ng (theo A.gi
ờ
) c
ầ
n
ñể
t
ạ
o ra 100g kali clorat theo
ph
ươ
ng pháp 2.
3.
Trong công nghi
ệ
p, brom
ñượ
c
ñ
i
ề
u ch
ế
t
ừ
n
ướ
c bi
ể
n theo quy trình nh
ư
sau: Cho m
ộ
t l
ượ
ng dung
d
ị
ch H
2
SO
4
vào m
ộ
t l
ượ
ng n
ướ
c bi
ể
n, ti
ế
p theo s
ụ
c khí clo vào dung d
ị
ch m
ớ
i thu
ñượ
c (1), sau
ñ
ó
dùng không khí lôi cu
ố
n h
ơ
i brom vào dung d
ị
ch Na
2
CO
3
t
ớ
i bão hòa brom (2). Cu
ố
i cùng cho
H
2
SO
4
vào dung d
ị
ch
ñ
ã bão hòa brom (3), thu h
ơ
i brom r
ồ
i hóa l
ỏ
ng.
(a)
Hãy vi
ế
t các ph
ươ
ng trình hóa h
ọ
c chính x
ả
y ra trong các quá trình (1), (2), (3).
(b)
Nh
ậ
n xét v
ề
m
ố
i quan h
ệ
gi
ữ
a ph
ả
n
ứ
ng x
ả
y ra
ở
(2) và (3).
5
ðÁP ÁN ðIỂM
1.
Hình v
ẽ
mô t
ả
thí nghi
ệ
m
ñ
i
ề
u ch
ế
khí Cl
2
khô
1,00
2.
(a) Ph
ươ
ng trình ph
ả
n
ứ
ng:
Ph
ươ
ng pháp 1: 6Cl
2
+ 6Ca(OH)
2
→
Ca(ClO
3
)
2
+ 5CaCl
2
+ 6H
2
O
Ca(ClO
3
)
2
+ 2KCl
→
2KClO
3
+ CaCl
2
0,50
Ph
ươ
ng pháp 2:
23
dpdd
2
232
222
H3KClOOH3KCl
OH3KClOKCl5KOH6Cl3
ClKOH2HKCl2OH2
+ →+
++→+
++→+
0,50
(b) 82,60
5,122
5,74100
m
KCl
=
×
=
gam
=××=×==
8,266
5,122
100
nF
M
m
ItQ
131,26
(A.gi
ờ
)
0,50
3.
(a) Các ph
ươ
ng trình ph
ả
n
ứ
ng:
Cl
2
+ 2NaBr
→ +
H
2NaCl + Br
2
(1)
3Br
2
+ 3Na
2
CO
3
→
5NaBr + NaBrO
3
+ 3CO
2
(2)
5NaBr + NaBrO
3
+ 3H
2
SO
4
→
3Na
2
SO
4
+ 3Br
2
+ 3H
2
O (3)
1,25
(b) (2) và (3) là các ph
ả
n
ứ
ng thu
ậ
n và ngh
ị
ch c
ủ
a cân b
ằ
ng:
3Br
2
+ 6OH
-
5Br
-
+ BrO
3-
+ 3H
2
O
OH
-
H
+
0,25
Câu V
(4
ñ
i
ể
m)
1.
Nh
ữ
ng thay
ñổ
i nào có th
ể
x
ả
y ra khi b
ả
o qu
ả
n lâu dài trong bình mi
ệ
ng h
ở
các dung d
ị
ch sau
ñ
ây:
(a) axit sunfuhi
ñ
ric, (b) axit bromhi
ñ
ric, (c) n
ướ
c Gia-ven, (d) dung d
ị
ch H
2
SO
4
ñậ
m
ñặ
c.
2.
H
ỗ
n h
ợ
p A g
ồ
m b
ộ
t S và Mg.
ð
un nóng A trong
ñ
i
ề
u ki
ệ
n không có không khí, sau
ñ
ó làm ngu
ộ
i
và cho s
ả
n ph
ẩ
m tác d
ụ
ng v
ớ
i dung d
ị
ch HCl (d
ư
) thu
ñượ
c 2,987 L khí B có t
ỉ
kh
ố
i so v
ớ
i không
khí b
ằ
ng 0,8966.
ðố
t cháy h
ế
t khí B, sau
ñ
ó cho toàn b
ộ
s
ả
n ph
ẩ
m vào 100ml H
2
O
2
5% (D =
1g/mL) thu
ñượ
c dung d
ị
ch D. Xác
ñị
nh % kh
ố
i l
ượ
ng các ch
ấ
t trong A và n
ồ
ng
ñộ
% các ch
ấ
t t
ạ
o
ra trong dung d
ị
ch D. Cho th
ể
tích các ch
ấ
t khí
ñ
o
ở
ñ
i
ề
u ki
ệ
n tiêu chu
ẩ
n.
3.
Hàm l
ượ
ng cho phép c
ủ
a t
ạ
p ch
ấ
t l
ư
u hu
ỳ
nh trong nhiên li
ệ
u là 0,30%. Ng
ườ
i ta
ñố
t cháy hoàn toàn
100,0 gam m
ộ
t lo
ạ
i nhiên li
ệ
u và d
ẫ
n s
ả
n ph
ẩ
m cháy (gi
ả
thi
ế
t ch
ỉ
có CO
2
, SO
2
và h
ơ
i n
ướ
c) qua
dung d
ị
ch KMnO
4
5,0.10
-3
M trong H
2
SO
4
thì th
ấ
y th
ể
tích dung d
ị
ch KMnO
4
ñ
ã ph
ả
n
ứ
ng v
ừ
a h
ế
t
v
ớ
i l
ượ
ng s
ả
n ph
ẩ
m cháy trên là 625 mL. Hãy tính toán xác
ñị
nh xem nhiên li
ệ
u
ñ
ó có
ñượ
c phép
s
ử
d
ụ
ng hay không?