
SÁNG KIẾN KINH NGHIỆM
HƯỚNG DẪN HỌC SINH GIẢI
BÀI TẬP THEO PHƯƠNG PHÁP
BẢO TOÀN NGUYÊN TỐ

PHẦN I: MỞ ĐẦU
I. LÍ DO CHỌN ĐỀ TÀI
Trong học tập môn hóa học, việc giải bài tập có một ý nghĩa. rất quan
trọng Ngoài việc rèn luyện kỹ năng vận dụng, đào sâu và mở rộng kiến thức
đã học một cách sinh động, bài tập hóa học còn được dùng để ôn tập, rèn
luyện một số kỹ năng về hóa học. Thông qua giải bài tập, giúp học sinh rèn
luyện tính tích cực, trí thông minh sáng tạo, bồi dưỡng hứng thú trong học
tập.Bài tập trắc nghiệm hóa học có tác dụng nâng cao mức độ tư duy, khả
năng phân tích phán đoán, khái quát của học sinh đồng thời rèn luyện kỹ
năng, kỹ xảo cho học sinh.
Qua quá trình giảng dạy, qua tham khảo tài liệu tôi dã tích lũy được
một số kinh nghiệm về phương pháp giải bài tập hóa học. Việc vận dụng
phương pháp bảo toàn nguyên tố vào giải nhanh một số bài tập hóa học tỏ ra
nhiều ưu việt, đặc biệt là khi các kỳ thi hiện nay đã chuyển đổi sang phương
pháp trắc nghiệm khách quan. Trong trường hợp này học sinh tiết kiệm được
rất nhiều thời gian tính toán cho kết quả nhanh, chính xác. Chính vì vậy tôi
chọn đề tài này:
“Hướng dẫn học sinh giải bài tập theo phương pháp bảo toàn nguyên
tố”
II-MỤC ĐÍCH CỦA SÁNG KIẾN
Giúp học sinh nghiên cứu cơ sở lý thuyết và phương pháp giải các bài
tập trắc
nghiệm theo phương pháp bảo toàn nguyên tố.
III. Đối tượng nghiên cứu
3.1 - Cơ sở lý luận về phương pháp giải bài tập toán hóa học theo phương

pháp b
ảo to
àn nguyên t
ố.
3.2 - Các dạng toán thường gặp học sinh vận dụng giải một số bài tập trắc
nghiệm hóa học.
3.3 - Từ việc nghiên cứu vận dụng đề tài , rút ra bài học kinh nghiệm góp
phần nâng cao chất lượng dạy và học môn hóa tại trường THPT số 1 Bắc Hà.
IV. Đối tượng khảo sát thực nghiệm
Đối tượng áp dụng là học sinh lớp 12A1,12A2 năm học: 2008-2009.
Lớp 11A2 , 10A1 năm học 2010-2011, lớp 11A2, 11A3 năm học 2011-2012
V . Phương pháp nghiên cứu
Đề tài được viết dựa trên cơ sở thực tế giáo viên hướng dẫn học sinh phương
pháp giải bài tập trắc nghiệm hóa học Trong đó có phương pháp truyền thống,
phương pháp bảo toàn nguyên tố.Tổ chức giảng dạy ở một số lớp, đánh giá
việc vận dụng phương pháp này sau khi đã được học tập. So sánh kết quả làm
bài với một số học sinh khác không vận dụng phương pháp bảo toàn nguyên
tố.
Trên cơ sở kết quả thu được, đánh giá ưu điểm và khái quát thành phương
pháp chung cho một số dạng bài tập hóa học có thể giải bằng phương pháp
này.
VI. Phạm vi và kế hoạch nghiên cứu đề tài
1.Phạm vi nghiên cứu
Phương pháp và kỹ thuật giải nhanh bài tập trắc nghiệm môn hóa học
2. Kế hoạch thùc hiÖn ®Ò tµi
Nghiên cứu thực trạng học sinh các lớp dạy từ năm học 2007-2008 đến nay
khảo
sát về khả năng giải bài tập trắc nghiệm hóa học.
Lập kế hoạch thực hiện đề tài trong học kỳ 1 năm học 2011-2012 ở 2 lớp

11A2, 11A3.
Nhận xét-kết luận về hiệu quả của đề tài ở học sinh lớp 11A2, 11A3
Hoàn thiện đề tài : Tháng 4 năm 2012
.
PHẦN II: NỘI DUNG
I.Cơ sở lý luận của phương pháp bảo toàn nguyên tố
1. Cơ sở của phương pháp
Nguyên tắc chung của phương pháp này là dựa vào §ịnh luật bảo toàn
nguyên tố (BTNT): “Trong các phản ứng hóa học thông thường, các nguyên
tố luôn được bảo toàn”.điều này có nghĩa là: Tổng số mol nguyên tử của một
nguyên tố X bất kì trước và sau phản ứng là luôn bằng nhau.
Điểm mấu chốt của phương pháp là phải xác định được đúng các hợp phần
chứa nguyên tố X ở trước và sau phản ứng , áp dụng định luật bảo toàn
nguyên tố với X rút ra mối quan hệ giữa các hợp phần kết luận cần thiết.
2. Một số chú ý
- Hạn chế viết phương trình phản ứng mà thay vào đó nên viết sơ đồ phản
ứng(sơ đồ hợp thức có chú ý hệ số ) biểu diễn các biến đổi cơ bản của các
nguyên tố quan tâm.
- Đề bài thường cho (hoặc qua dữ kiện bài toán sẽ tính được) số mol của
nguyên tố quan tâm, từ đó xác định được lượng (mol, khối lượng) của các
chất
- Phương pháp bảo toàn nguyên tố có thể áp dụng cho hầu hết dạng bài tập
đặc biệt là dạng bài hỗn hợp nhiều chất, xảy ra nhiều biến đổi phức tạp.
- Khi áp dụng phương pháp bảo toàn nguyên tố thường sử dụng kèm các
phương pháp b
ảo to
àn khác
( b
ảo to
àn kh
ối l
ư
ợng, electron)
II. Thực trạng vấn đề nghiên cứu
2.1. Khảo sát điều tra
Kháo sát lớp 12A2 (năm 2007), lớp 11A1, 12A2 ( năm 2008) lớp
10A1 (năm 2010).
*Giới thiệu hiện trạng khi chưa thực hiện đề tài
Trong mỗi năm học khi dạy bài tập về dạng này, tôi thường cho học sinh
làm một số bài tập nhỏ ( kiểm tra 15 phút) để đánh giá mức độ nắm vững
kiến thức và kỹ năng làm làm bài tập dạng này.
Tôi thường cho học sinh làm một số bài tập sau:
VD1: Hỗn hợp chất rắn A gồm 0,1 mol Fe2O3 và 0,1 mol Fe3O4. Hòa tan
hoàn toàn A bằng dung dịch HCl dư, thu được dung dịch B. Cho NaOH dư
vào B, thu được kết tủa C. Lọc lấy kết tủa, rửa sạch rồi đem nung trong không
khí đến khối lượng không đổi thu được m gam chất rắn D. Tính m.
VD2: Hòa tan hoàn toàn hh gồm 0,12 mol FeS2 và a mol Cu2S vào axit HNO3
( vừa đủ ) thì thu được dd X ( chỉ chứa 2 muối sunfat ) và khí duy nhất NO .
Giá trị của a là bao nhiêu ?
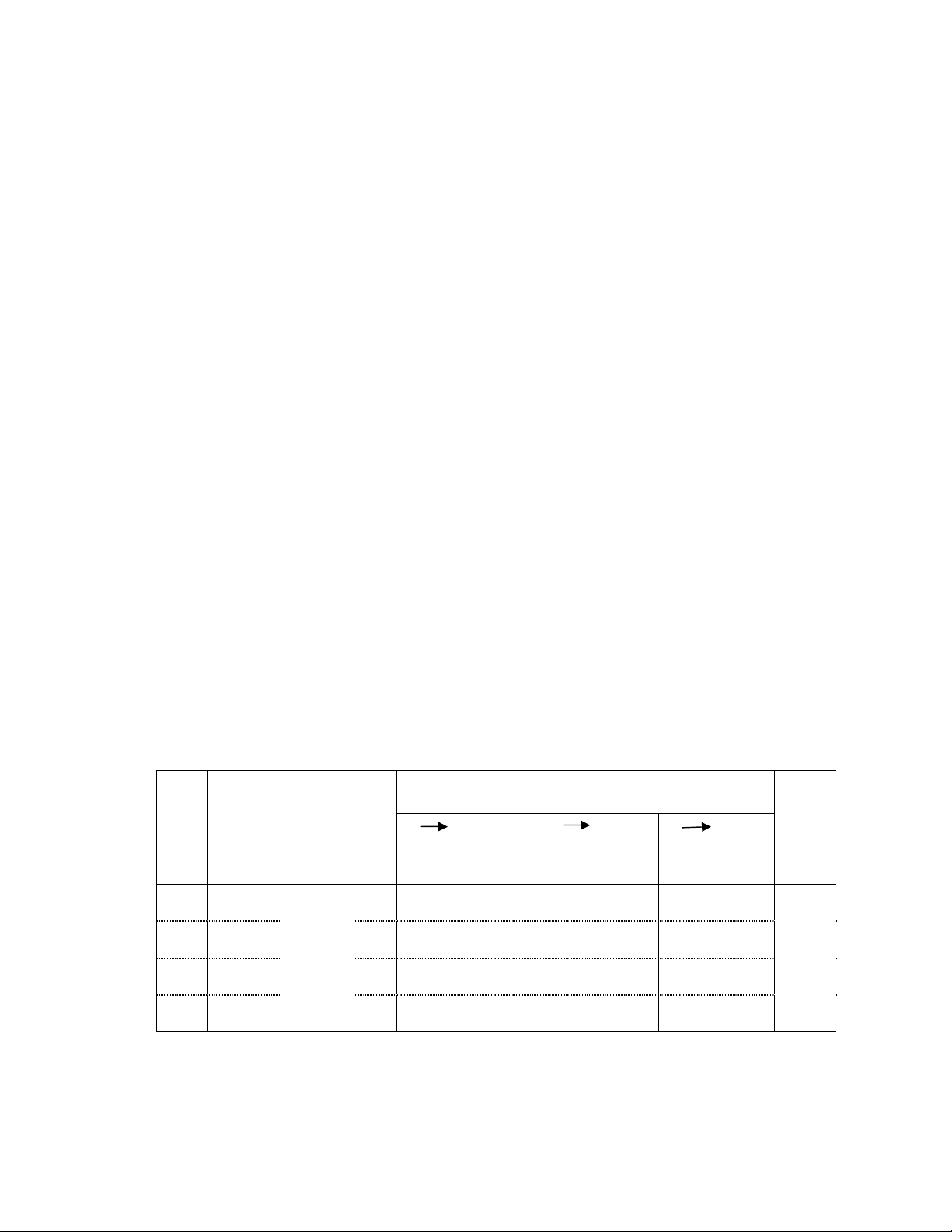
Sau khi chấm bài thu được kết quả như sau
STT
Khảo
sát tại Năm
S
ố
H
S
Điểm đạt được(%)
Ghi
0 < 5
5 < 7
7 10
1
12A2
2007
40
28(70
%)
10 (25
%)
2 (5
%)
Lí p ®¹ i
2
11 A1
2008
37
12 (32,4
%)
20 (54,
%)
5 (13,5
%)
L
ớp chọn
3
12A2
2008
36
13 (36,1
%)
18 (50
%)
5 (13
,8%)
Lí p ®¹ i
4
10 A1
2010
39
15 (38,4
%)
20 (51.3
%)
4 (10,3
%)
L
ớp chọn
Khi khảo sát ở các lớp khác nhau với những đối tượng khác nhau,tôi nhận
thấy có một số đặc điểm chung sau:



![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)










![Phiếu bài tập cuối tuần Tiếng Việt 1 tuần 2 đề 2: [Hướng dẫn chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250728/thanhha01/135x160/42951755577464.jpg)

