wWw.VipLam.Net
Tài li u b i d ng h c sinh gi i môn Hóaệ ồ ưỡ ọ ỏ
k ho ch b i d ng hsgế ạ ồ ưỡ
môn: Hoá H c 9ọ
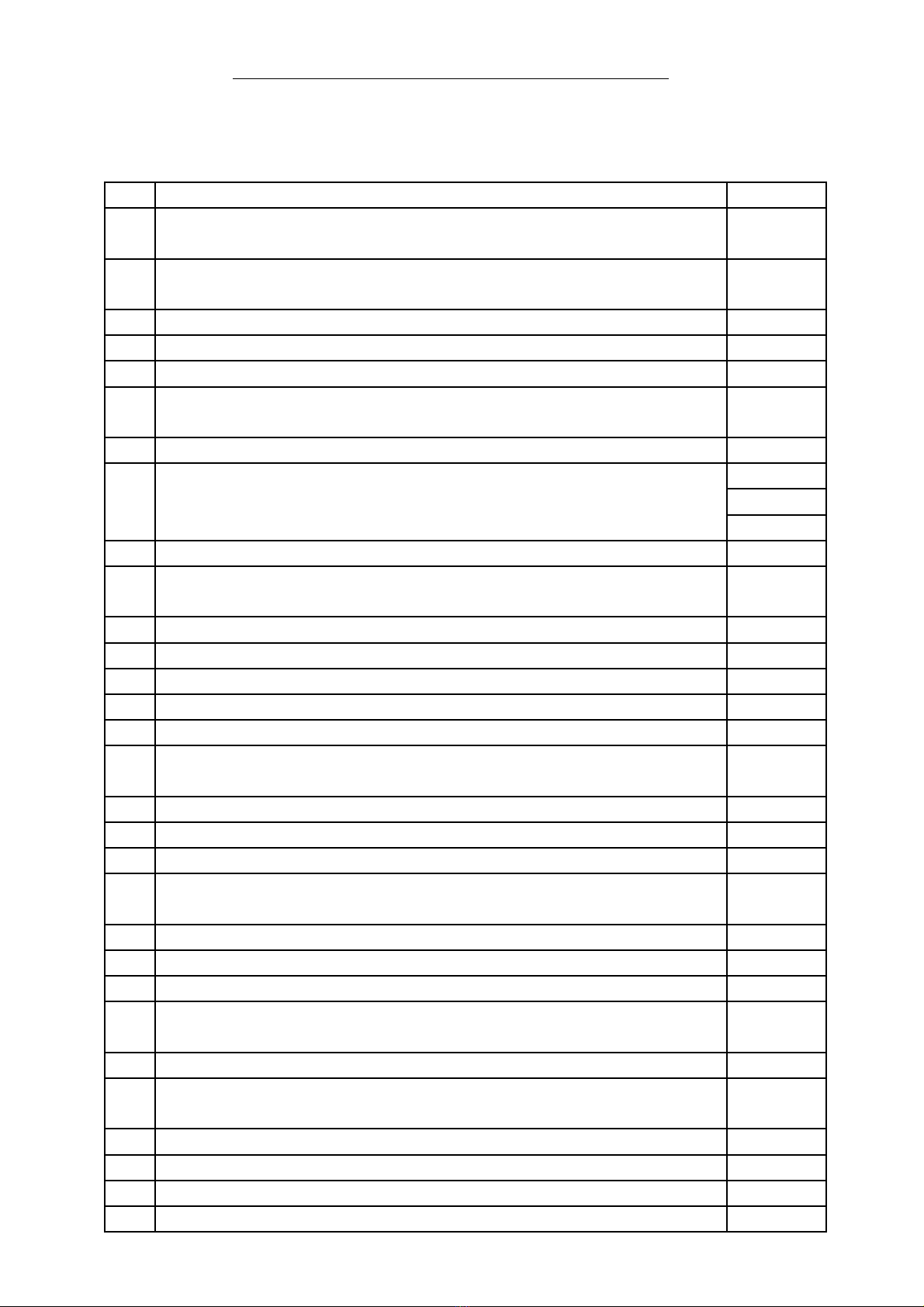
Stt Tên chuyên đềS ti tố ế
I Rèn luy n kĩ năng vi t CTHH, PTHH và các ph ng phápệ ế ươ
gi i toán hoá h c thông d ng.ả ọ ụ
1 Vi t, hoàn thành các ph ng trình hoá h c và h ng d n 1ế ươ ọ ướ ẫ
s ph ng pháp gi i toán hoá h c thông d ng.ố ươ ả ọ ụ 12
II V n d ng các công th c tính toán hoá h cậ ụ ứ ọ
1 Bài t p v đ tan, n ng đ dung d ch...ậ ề ộ ồ ộ ị 04
2 Bài t p pha tr n dung d ch các ch t ậ ộ ị ấ 08
III Tính theo PTHH: Xác đ nh công th c - Tính kh i l ng, thị ứ ố ượ ể
tích, n ng đ và thành ph n % c a các ch t. ồ ộ ầ ủ ấ
1 Xác đ nh công th c c a các ch t vô cị ứ ủ ấ ơ 04
2
a/ Bài t p Oxit tác d ng v i dung d ch axítậ ụ ớ ị
b/ Bài t p Oxít tác d ng v i dung d ch bazậ ụ ớ ị ơ
c/ Bài t p h n h p Oxítậ ỗ ợ
04
04
08
3 Bài t p dung d ch axit tác d ng v i kim lo iậ ị ụ ớ ạ 04
4 Bài t p dung d ch axít tác d ng v i bazậ ị ụ ớ ơ
(h n h p axit tác d ng v i h n h p baz )ỗ ợ ụ ớ ỗ ợ ơ 12
5 Bài t p dung d ch axít tác d ng v i mu iậ ị ụ ớ ố 04
6 Bài t p dung d ch baz tác d ng v i dung d ch mu i ậ ị ơ ụ ớ ị ố 04
7 Bài t p h n h p kim lo iậ ỗ ợ ạ 08
8 Bài t p h n h p mu i ậ ỗ ợ ố 08
9 Bài t p t ng h p c a ch đ tính theo PTHH.ậ ổ ợ ủ ủ ề 08
IV Nh n bi t – phân bi t, tách – tinh ch , đi u ch các ch t vôậ ế ệ ế ề ế ấ
c theo yêu c u. Vi t PTHH đ th c hi n s đ chuy n hoá.ơ ầ ế ể ự ệ ơ ồ ể
1 Bài t p nh n bi t – phân bi t các h p ch t vô cậ ậ ế ệ ợ ấ ơ 04
2 Bài t p tách – tinh ch các ch t vô cậ ế ấ ơ 04
3 Đi u ch các ch t vô cề ế ấ ơ 04
4 Vi t và hoàn thành các ph ng trình hoá h c đ th c hi n sế ươ ọ ể ự ệ ơ
đ chuy n hoá - chu i ph n ngồ ể ỗ ả ứ 04
V Hiđrocacbon – D n xu t c a hiđrôcacbonẫ ấ ủ
1 Vi t công th c c u t oế ứ ấ ạ 03
2 Nh n bi t, tinh ch và đi u ch ch t h u cậ ế ế ề ế ấ ữ ơ 04
3 Vi t ph ng trình hoá h c – s đ chuy n hoá - chu i ph nế ươ ọ ơ ồ ể ỗ ả
ngứ04
4 Xác đ nh công th c phân t h p ch t h u cị ứ ử ợ ấ ữ ơ 04
5 Tính theo PTHH: Tính đ r u, n ng đ và thành ph n % vộ ượ ồ ộ ầ ề
kh i l ng, th tích c a các ch t h u c trong h n h p.ố ượ ể ủ ấ ữ ơ ỗ ợ
a Bài t p h n h p hiđrôcacbonậ ỗ ợ 04
b Bài t p h n h p r uậ ỗ ợ ượ 04
c Bài t p h n h p axit h u cậ ỗ ợ ữ ơ 04
d Bài t p t ng h pậ ổ ợ 08
1








![Bài tập so sánh hơn và so sánh nhất của tính từ [kèm đáp án/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250808/nhatlinhluong27@gmail.com/135x160/77671754900604.jpg)
![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)




![Tài liệu Lý thuyết và Bài tập Tiếng Anh lớp 6 [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250802/hoihoangdang@gmail.com/135x160/18041754292798.jpg)





