
THẦY CƯỜNG PLEIKU – DẠY KÈM TOÁN – LÝ – HÓA
Page | 1
TÀI LIỆU HỌC THÊM
MÔN KHOA HỌC TỰ NHIÊN 7
Năm học: 2024 – 2025
PHẦN I
HÓA HỌC

THẦY CƯỜNG PLEIKU – DẠY KÈM TOÁN – LÝ – HÓA
Page | 2
THẦY CƯỜNG PLEIKU – DẠY KÈM TOÁN – LÝ – HÓA
Page | 3
TH
Ầ
Y CƯ
Ờ
NG PLEIKU
ĐỊA CHỈ: 74A VÕ TRUNG THÀNH
SĐT: 0989 476 642
KHOA HỌC TỰ NHIÊN 7
CHỦ ĐỀ: NGUYÊN TỬ
PHẦN I. LÝ THUYẾT
1. Khái niệm nguyên tử
- Các chất đều được tạo nên từ những hạt vô cùng nhỏ, gọi là nguyên tử.
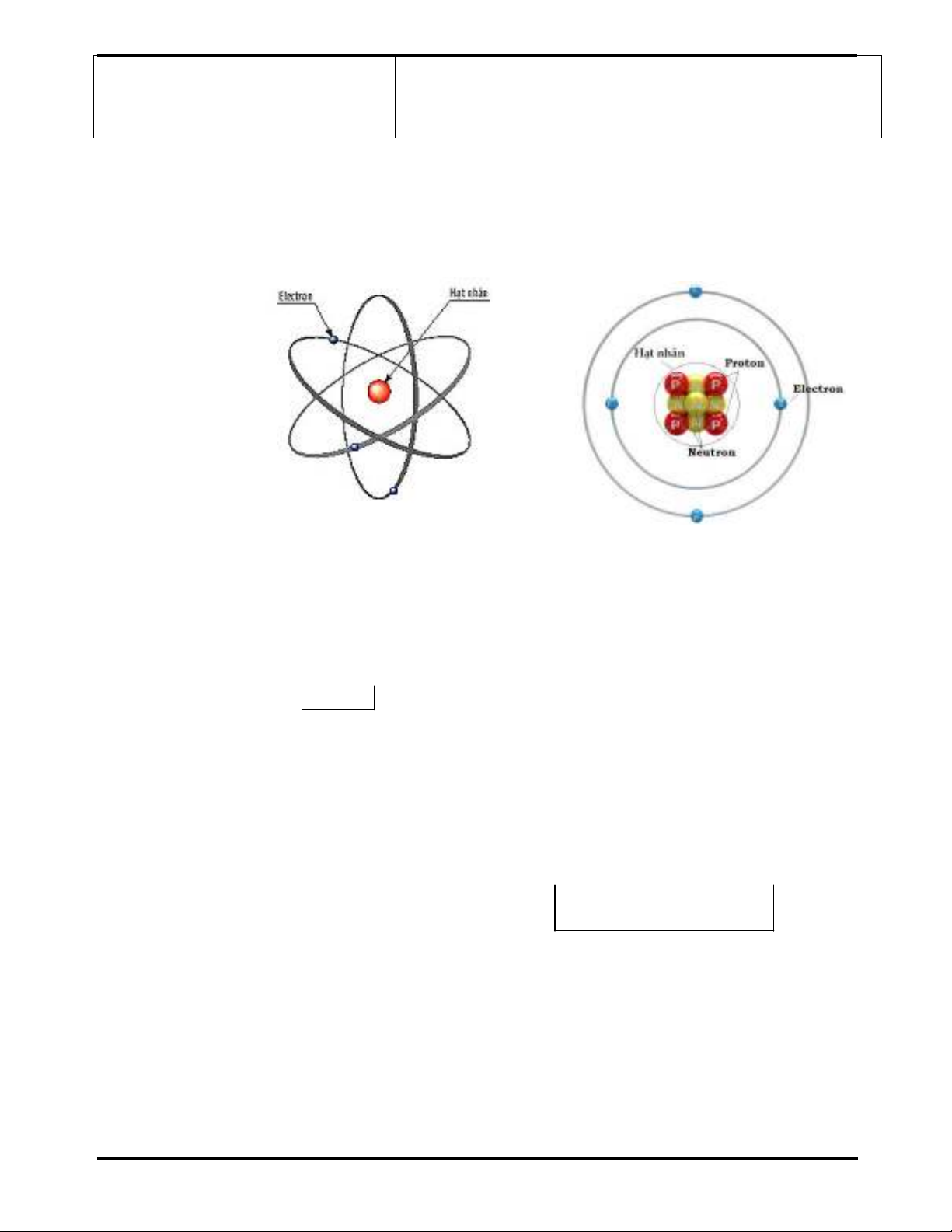
2. Mô hình nguyên tử Rutherford – Bohr.
- Cấu tạo của nguyên tử:
+ Hạt nhân: gồm proton (+) và neutron không mang điện.
+ Lớp vỏ: các electron (-) xếp thành từng lớp và chuyển động xung
quanh hạt nhân. (đám mây electron)
- Nguyên tử trung hòa về điện: số proton (+) bằng số electron (-).
- Số đơn vị điện tích hạt nhân, kí hiệu là Z, bằng tổng số hạt proton trong hạt
nhân. Z p e
Ví dụ: nguyên tử oxygen có
8Z
, nguyên tử carbon có
6Z
.
3. Khối lượng nguyên tử
- Khối lượng nguyên tử bằng tổng khối lượng của các hạt proton, neutron trong
hạt nhân và electron ngoài lớp vỏ.
Vì khối lượng của electron rất nhỏ nên ta có thể coi khối lượng hạt nhân
nguyên tử là khối lượng của nguyên tử.
- Đơn vị khối lượng nguyên tử:
amu
.
24
1
1 1,6605.10
12
C
amu m g
+ Khối lượng của 1 proton gần đúng bằng khối lượng của 1 neutron và
xấp xỉ bằng
1amu
.
+ Một electron có khối lượng xấp xỉ
0, 00055 amu
.
Ví dụ: Khối lượng của nguyên tử nhôm
13 ,14p n
là
27 amu
.
THẦY CƯỜNG PLEIKU – DẠY KÈM TOÁN – LÝ – HÓA
Page | 4
PHẦN II. BÀI TẬP
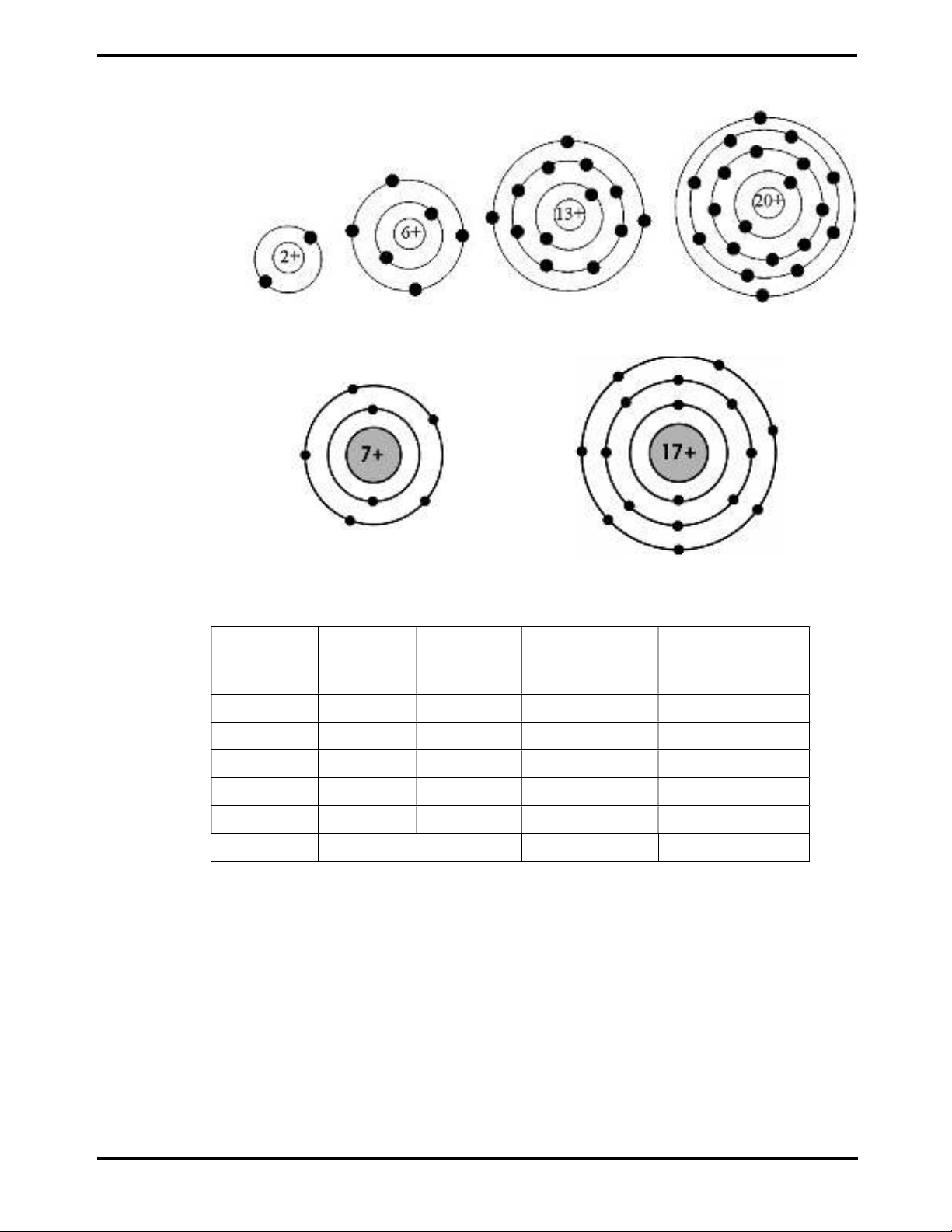
Bài 1. Quan sát mô hình các nguyên tử và hoàn thành bảng sau
Nguyên tử Số proton Số electron
Số lớp electron
Số electron ở lớp
ngoài cùng
Helium
Carbon
Aluminium
Calcium
Nitrogen
Chlorine
Bài 2. Tính khối lượng của các nguyên tử sau ra đơn vị
amu
và đơn vị gam .
30 ,35 ; 1 ; 6 ,6 ; 12 ;12 ; 19 , 20 ; 8 ,8Zn p n H p C p n Mg p n K p n O p n
.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Helium Carbon Aluminum Calcium
Nitrogen
Chlorine

THẦY CƯỜNG PLEIKU – DẠY KÈM TOÁN – LÝ – HÓA
Page | 5
Bài 3. Biết rằng trong nguyên tử số proton bằng số electron
p e
và tổng số hạt cơ
bản được tính là
2
n p e n p p n p
a) Cho nguyên tử Lithium có tổng số hạt cơ bản là 10, số proton là 3. Tính số hạt
electron và neutron.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
b) Hạt nhân nguyên tử Barium có 56 proton, 25 neutron. Tính số electron và tổng số
hạt cơ bản của nguyên tử Barium.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Bài 4. Một hạt nhân nguyên tử có 143 neutron và 92 electron. Tìm số proton và tổng
số hạt cơ bản của nguyên tử đó.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Bài 5*. Nguyên tử X có tổng số hạt cơ bản (electron, neutron và proton) là 58 hạt. Biết
rằng trong nguyên tử X có số hạt mang điện nhiều hơn số hạt không mang điện là 18
hạt. Tìm số hạt electron, proton và neutron trong nguyên tử X.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Bài 6*. Nguyên tử của nguyên tố X có tổng số hạt electron , proton, nơtron bằng 21,
số hạt mang điện gấp 2 lần số hạt không mang điện. Tính số electron, proton và
neutron trong một nguyên tử X.
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………



![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)










![Phiếu bài tập cuối tuần Tiếng Việt 1 tuần 2 đề 2: [Hướng dẫn chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250728/thanhha01/135x160/42951755577464.jpg)

