
Tóm Tắt kiến thức Hóa Học 10 [Cơ Bản]
Bài 1: THÀNH PHẦN NGUYÊN TỬ
I-Thành phần cấu tạo của nguyên tử.
1. Electron:
a) Sự tìm ra electron: (1897-Tôm-Xơn)
- Tia âm cực gồm chùm hạt electron mang điện tích âm và mỗi hạt đều có khối lượng được gọi là electron.
b)Khối lượng, điện tích.
me = 9,1.10-31 kg.
qe = -1,6.10-19 (C)= 1-
2. Sự tìm ra hạt nhân: (1911- Rơ-Dơ- pho)
-Nguyên tử có cấu tạo rỗng, phần mang điện dương là hạt nhân. Xung quanh hạt nhân có các e tạo nên
vỏ nguyên tử
-Vì me <<0,mnguyên tử = mhạt nhân
3. Cấu tạo của hạt nhân nguyên tử:
- Chứa proton (p) và nơtron (n).
- Khối lượng: mp~mn~1,67.10-27kg ~1u.
- Điện tích:
qp = + 1,6.10-19 (c) = 1+.
qn = 0 (hạt trung hòa)
II. Kích thước và khối lượng của nguyên tử.
1. Kích thước:
dnt = 10-10 m =10-1nm =1A0
dhn=10-14 m =10-5 nm =10-4 (A0).
de=dp =10-17m =10-8nm =10-7 A0.
2. Khối lượng:
- 1u = 1/12 khối lượng của một nguyên tử đồng vị cacbon 12. - Nguyên tử này có khối lượng là 19,9265.10-
27kg.
- 1u = 19,9265.10-27/12= 1,6605.10-27kg
mp ~ mn ~ 1u.
Bài 2: HẠT NHÂN NGUYÊN TỬ. NGUYÊN TỐ HÓA HỌC. ĐỒNG VỊ
I. HẠT NHÂN NGUYÊN TỬ:
1. Điện tích hạt nhân:
- Nếu hạt nhân nguyên tử có Z hạt proton thì điện tích hạt nhân là Z+ và số đơn vị điện tích hạt nhân là Z.
Vì vậy: số đơn vị điện tích hạt nhân = số p = số e =Z
2. Số khối:
- Số khối của hạt nhân (A) bằng tổng số prton(Z) và tổng số nơtron (N)
- Công thức: A = Z + N
Ví dụ: Li có 3P và 4n " A = 7
II. NGUYÊN TỐ HÓA HỌC:
I. Định nghĩa:

- Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân nhưng khác số khối.
- Những nguyên tử có cùng điện tích hạt nhân đều có tính chất hóa học giống nhau.
2. Số hiệu nguyên tử:
- Số đơn vị điện tích hạt nhân (Z) của một nguyên tố được gọi là số hiệu nguyên tử của nguyên tố đó.
Vậy: số hiệu nguyên tử =số đơn vị điện tích hạt nhân = số p = số e =Z
Bài 4: CẤU TẠO VỎ NGUYÊN TỬ
I.Sự chuyển động của electron trong nguyên tử.
-Các e chuyển động rất nhanh xung quanh hạt nhân nguyên tử không theo những quỹ đạo xác định tạo
nên vỏ nguyên tử.
-Số e ở vỏ nguyên tử = Số Proton trong hạt nhân nguyên tử = Số thứ tự Z của nguyên tử nguyên tố đó
trong BTH
II) Lớp electron và phân lớp electron:
1) Lớp electron:
- Ở trạng thái cơ bản, các e lần lượt chiếm các mức năng lượng từ thấp đến cao.
- Các e trên cùng 1 lớp có mức năng lượng gần bằng nhau.
+ Lớp(n): 1 2 3 4
+Tên lớp: K L M N
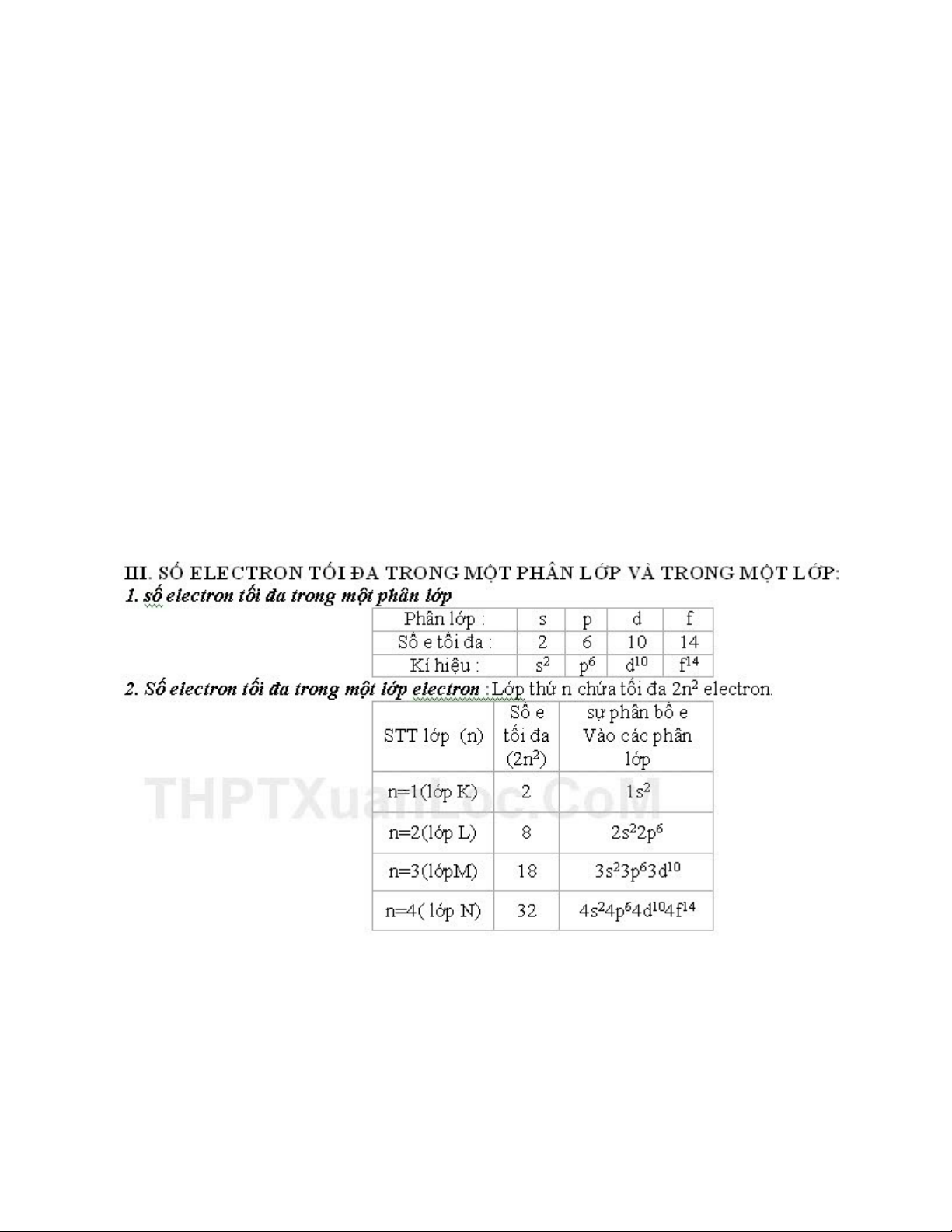
2) Phân lớp electron: Gồm các electron có năng lượng bằng nhau.
- Các phân lớp được kí hiệu bằng các chữ cái s, p, d, f.
Vd:
Lớp K(n=1) có 1 phân lớp: 1s.
Lớp L(n=2) có 2 phân lớp: 2s,2p.
Lớp M(n=3) có 3 phân lớp: 3s,3p,3d.
Lớp N(n=4) có 4 phân lớp: 4s,4p,4d,4f.
Vậy : Lớp thứ n có n phân lớp.
Bài 5 : CẤU HÌNH ELECTRON NGUYÊN TỬ

II.CẤU HÌNH ELECTRON TRONG NGUYÊN TỬ
1. Cấu hình electron nguyên tử :
- Cấu hình electron của nguyên tử biểu diễn sự phân bố electrron trên các phân lớp thuộc các lớp khác
nhau.
* Quy ước cách viết cấu hình electron :
- STT lớp e được ghi bằng chữ số (1, 2, 3. . .)
- Phân lớp được ghi bằng các chữ cái thường s, p, d, f.
- Số e được ghi bằng số ở phía trên bên phải của phân lớp.(s2 , p6 )
* Cách viết cấu hình electron:
- Xác định số electron của nguyên tử.
- Phân bố electron vào các phân lớp theo chiều tăng mức năng lượng( bắt đầu là 1s), chú ý số e tối đa
trên s, p, d, f.

- Sắp xếp lại theo sự phân bố thứ tự các lớp.
Bài 7: BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
I) Nguyên Tắc Sắp Xếp Các Nguyên Tố Trong Bảng Tuần Hoàn:
1.Các nguyên tố được sắp xếp theo chiều tăng của điện tích hạt nhân.
2.Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
3.Các nguyên tố có số electron hóa trị trong nguyên tử như nhau được xếp thành một cột.
II) Cấu Tạo Bảng Tuần Hoàn Các Nguyên Tố Hóa Học :
1) Ô nguyên tố:
Mỗi nguyên tố hóa học được xếp vào một ô của bảng tuần hoàn gọi là ô nguyên tố.
STT của ô = Số hiệu nguyên tử nguyên tố đó.
ví dụ: Al ở ô số 13 suy ra số hiệu nguyên tử là 13, có 13p, 13e.
2/ Chu kì :
- Chu kì là dãy những nguyên tố mà nguyên tử của chúng có cùng số lớp electron được xếp theo chiều
điện tích hạt nhân tăng dần.
- STT chu kì = số lớp electron.
- Chu kì nào cũng bắt đầu bằng kim loại kiềm và kết thúc bằng khí hiếm.
*Chu kì 1 có 2 nguyên tố là H và He.
*Chu kì 2 có 8 nguyên tố bắt đầu bằng kim loại kiềm Li và kết thúc là khí hiếm Ne.
*Chu kì 3 có 8 nguyên tố bắt đầu bằng kim loại kiềm Na và kết thúc là khí hiếm Ar.





![Bài tập so sánh hơn và so sánh nhất của tính từ [kèm đáp án/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250808/nhatlinhluong27@gmail.com/135x160/77671754900604.jpg)
![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)




![Tài liệu Lý thuyết và Bài tập Tiếng Anh lớp 6 [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250802/hoihoangdang@gmail.com/135x160/18041754292798.jpg)




