Đi nhi u thì nh đng. làm nhi u thì quen cách!!!ề ớ ườ ề
CHUYÊN Đ 1: ESTE- LIPITỀ
A. Ki n th c c n n m v ng ế ứ ầ ắ ữ
I- Este
1. Khái ni m và công th c c a m t s esteệ ứ ủ ộ ố
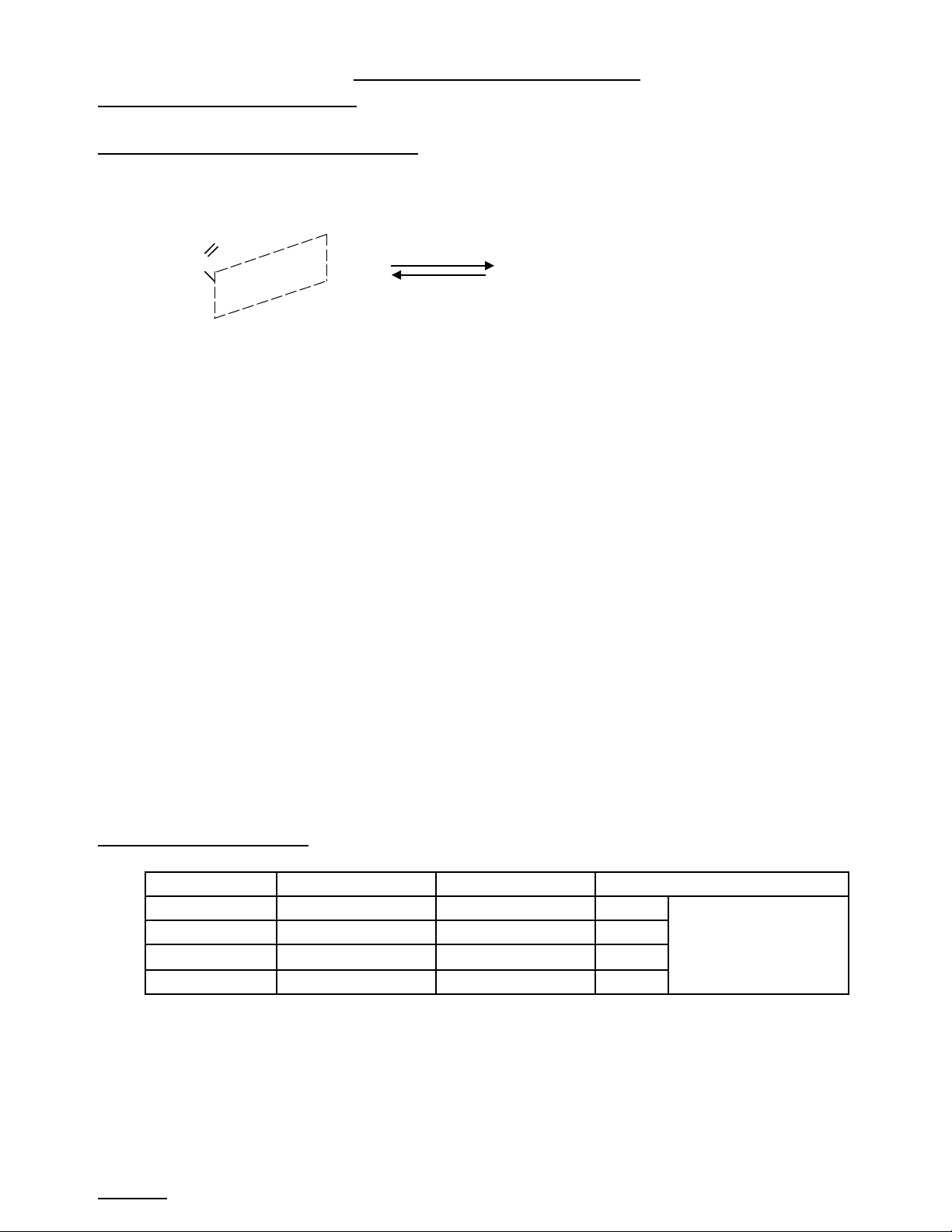
a) Khái n mệ: Khi thay nhóm –OH nhóm cacbonyl c a axit cacboxylic b ng nhóm ORở ủ ằ ’ thì đc este ( Rượ ’ là g cố
hiđrocacbon)
VD:
Axit cacboxylic Ancol Este
b) Công th c c a m t s esteứ ủ ộ ố :
Công th c t ng quát c a este là: Cứ ổ ủ nH2n+2-2k-2aO2a
Trong đó : n là s nguyên t cacbon ( n≥ 2)ố ử
k là s liên k t ố ế Π trong g c hiđrocacbon ho c s vòng ( k≥ 0)ố ặ ố
a là s nhóm ch c –COO- c a este( a≥ 1)ố ứ ủ
- Este no, đn ch c, m ch hơ ứ ạ ở( k= 0, a=1):
Công th c chung: CứnH2nO2 ( n≥2) ho c CặnH2n+1COOCmH2m+ 1( n≥0, m≥ 1)
Ho c t ng quát h nặ ổ ơ : RCOOR’ ( R, R’ là các g c hiđrocacbon no).ố
VD: HCOOCH3, CH3COOCH3, CH3COOC2H5…
- Este không no( có 1 liên k t đôi C=C), đn ch c, m ch h ( k=1,a=1): Công th c chung: Cế ơ ứ ạ ở ứ nH2n-2O2 (n≥3) ho cặ
RCOOR’ ( trong 2 g c R, R’ là g c no và g c không no)ố ố ố
VD: HCOOCH=CH2, CH2=CH-COOCH3, CH2=C(CH)3-COOCH3…
- Este t o b i ancol đn ch c và axit đn ch c:ạ ở ơ ứ ơ ứ RCOOR’ ( R, R’ là g c hiđrocacbon no, không no ho c th m).ố ặ ơ
VD: CH3COOC2H5, CH2=CH-COOCH3, C6H5COOCH3…
- Este t o b i ancol đa ch cạ ở ứ R’(OH)m v i axit đn ch cớ ơ ứ RCOOH: CT chung: (RCOO)mR’ ( m là s nhó OH, m>ố
1)
VD: Este t o b i glixerol: Cạ ở 3H5(OH)3 v i axit axetic CHớ3COOH có công th c là: (CHứ3COO)3C3H5
- Este t o b i ancol đn ch cạ ở ơ ứ R’OH v i axit đa ch cớ ứ R(COOH)n là: R(COOR’)n ( n là s nhóm COOH, n>1)ố
VD: Este t o b i ancol etylic Cạ ở 2H5OH v i axit ađipic HOOC-(CHớ2)4-COOH là (CH2)4(COOC2H5)2
- Este t o b i ancol đa ch cạ ở ứ R’(OH)m và axit đa ch cứ R(COOH)n là: Rm(COO)m.nR’n
VD: Este t o b i glixerol v i axit ađipic là: [(CHạ ở ớ 2)4]3(COO)6(C3H5)2
2. Đng phân và danh pháp:ồ
a) Đng phânồ: S đng phân Esteố ồ : 2n-2
CTPT S đng phân esteố ồ S đng phân axitố ồ T ng đng phân đn ch cổ ồ ơ ứ
C2H4O21 1 2
Đu tác d ng v iề ụ ớ
ki m (NaOH, KOH)ề
C3H6O22 1 3
C4H8O24 2 6
C5H10O28 4 12
Este có đng phân v m ch cacbon, đng phân v nhóm ch c axit cacboxylic đn ch c, đng phân khác ch cồ ề ạ ồ ề ứ ơ ứ ồ ứ
v i anol, anđehit, xeton…ớ
VD: ng v i công th c Cứ ớ ứ 4H8O2
+ Đng phân m ch Cacbon: ồ ạ
HCOOCH2-CH2-CH3 (1), HCOOCH(CH3)CH3 (2) , CH3COOC2H5 (3), C2H5COOCH3 (4)
+ Đng phân v nhóm ch c v i axit: CHồ ề ứ ớ 3-CH2-CH2-COOH (5), CH3-CH(CH3)-COOH (6)
+ Đng phân khác ch c: ồ ứ
CH2=CH-CH(OH)-CH2OH (7) , HO-CH2-CH2-CH2 -CHO (8), CH3-CH(OH)-CH2-CHO (9)
CH3-CH2-CH(OH)-CHO (10)…
Nh n xétậ: + Nh v y este Cư ậ 4H8O2 có 4 đng phân c u t o: 1,2,3,4ồ ấ ạ
+ H – OR’
R - C
O
OH RCOOR’ + H2O
H2SO4 đc, tặo
1

Đi nhi u thì nh đng. làm nhi u thì quen cách!!!ề ớ ườ ề
+ H p ch t h u c đn ch c Cợ ấ ữ ơ ơ ứ 4H8O2 có 6 đng phân: 1,2,3,4,5,6ồ
+ H p ch t h u c Cợ ấ ữ ơ 4H8O2 có r t nhi u đng phân ( 16 đng phân)ấ ề ồ ồ
b) Danh pháp :
Tên c a este= Tên g c hidđrocacbon Rủ ố ’ + Tên anion g c axit ( đuôi “at”)ố
STT Công th c c a esteứ ủ Tên g iọ
1 HCOOCH3Metyl fomat
2 CH3COOCH3Metyl axetat
3 CH3COOC2H5Etyl axetat
4 C2H5COOCH3Metyl propionat
5 HCOOCH2CH2CH3Propyl fomat
6 HCOOCH(CH3)CH3Isopropyl fomat
7 HCOOC6H5Phenyl fomat
8 C6H5COOC2H5Etyl benzoat
9 CH2=CH-COOCH3Metyl acrylat
10 CH3COOCH=CH2Vinyl axetat
11 CH2=C(CH3)-COOCH3Metyl metacrylat
12 CH3COOCH2C6H5Benzyl axetat
3. Tính ch t v t lí c a esteấ ậ ủ :
- Este th ng là ch t l ng ho c ch t r n, không tan trong n c th ng nh h n n c, có mùi th m đc tr ng, ườ ấ ỏ ặ ấ ắ ướ ườ ẹ ơ ướ ơ ặ ư
d ch u ễ ị
- Các este có nhi t đ sôi th p h n so v i axit và ancol có cùng s nguyên t cacbon ho c cùng PTK vìệ ộ ấ ơ ớ ố ử ặ
gi a các phân t este không có liên k t hiđroữ ử ế
Đc đi m c a este là có mùi th m d ch u, gi ng mùi qu chin. Thí d Etyl Fomiat có mùi qu táo, isomul axetatặ ể ủ ơ ễ ị ố ả ụ ả
có mùi chu i chin, amyl propinat có mùi d a chin…ố ứ
M t s este có mùi th m tinh d u hoa qu đc s d ng trong công nghi p th c ph m, m ph m, d cộ ố ơ ầ ả ượ ử ụ ệ ự ẩ ỹ ẩ ượ
ph m:ẩ
Tên este Mùi th mơPh ng trình đi u ch t ancol và axitươ ề ế ừ
Benzyl axetat Mùi hoa nhàiCH3COOH + C6H5CH3OH
đSOH
42
CH3COOC6H5CH3 + H2O
Etyl fomiat Mùi đào chin HCOOH + C2H5OH
đSOH
42
HCOOC2H5 + H2O
Amyl axetat Mùi d u chu iầ ố CH3COOH + CH3[CH2]4OH
đSOH
42
CH3COO[CH2]4CH3 + H2O
Isoamyl axetat Mùi chu i chin ốCH3COOH + CH3CH(CH3)CH2CH2OH
đSOH
42
CH3COOCH2CH2CH(CH3)CH3 + H2O
Isobutyl propionat Mùi ancol rum CH3CH2COOH + CH3CH(CH3)CH2OH
đSOH
42
CH3CH2COOCH2CH(CH3)CH3 + H2O
Metyl salixylat Mùi d u gióầCH3OH + HO-C6H4-COOH
đSOH
42
HO-C6H4- COOCH3 + H2O
Metyl 2-amino
benzoat
Mùi hoa cam CH3OH + H2N-C6H4COOH
đSOH
42
H2H-C6H4-COOCH3 + H2O
Metyl fomiat Mùi táo CH3OH + HCOOH
đSOH
42
HCOOCH3 + H2O
Butyl butirat Mùi d aứCH3[CH2]3OH + CH3CH2CH2COOH
đSOH
42
CH3CH2CH2COO[CH2]3CH3 + H2O
Geranyl axetat Mùi hoa h ng ồCH3COOH + C10H17OH
đSOH
42
CH3COOC10H17 + H2O
2

Đi nhi u thì nh đng. làm nhi u thì quen cách!!!ề ớ ườ ề
4. Tính ch t hóa h cấ ọ
a) Tính ch t chung c a esteấ ủ : Ph n ng th y phân este trong môi tr ng axit và ki mả ứ ủ ườ ề
- Th y phân este trong môi tr ng axit: Ph n ng thu n ngh ch, s n ph m là axit và ancol:ủ ườ ả ứ ậ ị ả ẩ
- Th y phân este trong môi tr ng ki m( Ph n ng xà phòng hóa) : ủ ườ ề ả ứ Ph n ng m t chi u, s n ph m là mu i vàả ứ ộ ề ả ẩ ố
ancol
Etyl axetat Natri axetat ancol etylic
* Chú ý:
- M t s ph n ng th y phân đc bi t:ộ ố ả ứ ủ ặ ệ
* Este có d ng HCOOR’ : có ph n ng tráng g ng (HCOOR’ 2Ag)→ạ ả ứ ươ
* Este RCOOCH=CH-R’ : RCOOCH=CH-R’ + H2O
o
t
RCOOH + R’CH2CHO (andehit)
RCOOCH=CH-R’ + NaOH RCOONa + R→’CH2CHO
* Este RCOOC6H5 RCOOC6H5 + 2NaOH RCOONa + C→6H5ONa + H2O
- Cách xác đnh s nhóm ch c este: ( tr tr ng h p là este d ng RCOOCị ố ứ ừ ườ ợ ạ 6H5)
- Ph n ng cháy: ả ứ
CnH2nO2 + (3n-2)/2O2 nCO→2 + nH2O
S mol Hố2O = S mol COố2 este no, đn ch c→ơ ứ
b) Tính ch t riêng c a esteấ ủ
- Các este c a axit fomic có tính ch t nh anđehit: Ph n ng c ng Hủ ấ ư ả ứ ộ 2, làm m t màu dung d ch Brấ ị 2, có ph n ng ả ứ
tráng g ng v i dd AgNOươ ớ 3/NH3, kh Cu(OH)ử2 thành Cu2O…
Ph n ng tráng g ng x y ra các este fomiat khi ph n ng v i dung d ch AgNOả ứ ươ ả ở ả ứ ớ ị 3/NH3
HOOC-CH3 + 2AgNO3 + 3NH3 + H2O
0
t
NH4O-COOCH3 + 2Ag + 2 NH4NO3
H - C - O C2H5 + Ag2O
3
0
NH
t
2Ag + CO2 + C2H5OH
HOOC-CH2CH3 + Br2 + H2O
0
t
OHCOOC2H5 + 2HBr
HOOC-CH(CH3)CH3 + Cu(OH)2 + NaOH
0
t
Na2CO3 + HO- CH(CH3)CH3 +Cu2O + 3H2O
- Ph n ng t o hai mu i: x y ra các este phenyl khi ph n ng v i dung d ch NaOH.ả ứ ạ ố ả ở ả ứ ớ ị
CH3 - COOC6H5 + 2NaOH
0
t
CH3COONa + C6H5ONa + H2O
- Ph n ng t o axit và anđehit: x y ra các este vinyl khi th y phânả ứ ạ ả ở ủ
CH3 - COO - CH = CH2 + H2O
0
,H t
+
CH3COOH + CH3CHO
- Các este c a axit fomic có tính ch t nh anđehit: Ph n ng c ng Hủ ấ ư ả ứ ộ 2, làm m t màu dung d ch Brấ ị 2, có ph n ng ả ứ
tráng g ng v i dd AgNOươ ớ 3/NH3, kh Cu(OH)ử2 thành Cu2O…
CH3COOC2H5 + H2OCH3COOH + C2H5OH
H+, to
to
3
CH3COOC2H5 + NaOH CH3COONa + C2H5OH
S nhóm ch c este = ố ứ S mol NaOH ( ho c KOH) ố ặ
S mol este ố
O
Đi nhi u thì nh đng. làm nhi u thì quen cách!!!ề ớ ườ ề
- Các este có g c không no có tính ch t gi ng anken: Ph n ng c ng( Hố ấ ố ả ứ ộ 2, halogen, HX…), ph n ng trùng h p, ả ứ ợ
ph n ng oxi hóa…ả ứ
VD: CH2=CH-COOCH3 + H2 Ni, to CH3-CH2-COOCH3
CH2=CH-COOH + Br2 CH→2Br-CHBr-COOCH3
5. Đi u ch ề ế
a) Ph ng pháp chung: ươ Dùng ph n ng este hóa gi a ancol và axit cacboxylicả ứ ữ
b) Ph ng pháp riêng:ươ
- Các este có d ng RCOOCH=CHạ2 không đi u ch b ng p este hóa mà dùng ph n ng riêng. ề ế ằ ư ả ứ
VD: CH3COOH + CH CH ≡xt, to CH3COOCH=CH2
- Các este c a phenol không đi u ch đc b ng ph n ng c a phenol v i axit mà dùng ph n ng:ủ ề ế ượ ằ ả ứ ủ ớ ả ứ
(CH3CO)2O + C6H5OH CH→3COOC6H5 + CH3COOH
Anhiđrit axetic phenol phenyl axetat
6. ng d ngỨ ụ
- Trong công nghi p th c ph m, m t s este có mùi th m hoa qu , không đc, đc dung đ tăng them h ngệ ự ẩ ộ ố ơ ả ộ ượ ể ươ
v cho bánh k o, n c gi i khát…ị ẹ ướ ả
- Trong công nghi p m ph m, m t s este có mùi th m h p d n đc pha vào n c hoa, xà phòng th m, kemệ ỹ ẩ ộ ố ơ ấ ẫ ượ ướ ơ
bôi…
- Nhi u este có kh năng hoà tan nhi u ch t h u c nên đc dùng đ pha s n.ề ả ề ấ ữ ơ ượ ẻ ơ
- M t s este là nguyên li u đ s n xu t s i t ng h p, thu tinh h u cộ ố ệ ể ả ấ ợ ổ ợ ỷ ữ ơ
II- Lipit
1. Khái ni mệ: Lipit là nh ng h p ch t h u c có trong t bào s ng c a đng th c v t, không tan trong n cữ ợ ấ ữ ơ ế ố ủ ộ ự ậ ướ
nh ng tan t t trong các dung môi h u c nh ete, clofrom, xăng…ư ố ữ ơ ư
- Lipit g m: Ch t béo, sáp, steroit, photpholipit…ồ ấ
2. Ch t béoấ
a) Khái ni mệ: Ch t béo là trieste c a glixerol v i axit béo, g i chung là triglixerit hay triaxylglixerolấ ủ ớ ọ .
Axit béo
+ glixerol [C3H5(OH)3]
- 3H2O
Ch t béoấ
C17H35COOH
axit stearic
(C17H35COO)3C3H5
tristearin
C17H33COOH
axit oleic
(C17H33COO)3C3H5
triolein
C15H31COOH
axit panmitic
(C15H31COO)3C3H5
tripanmitin
Khi thu phân lipit (ch t béo) ng i ta thu đc glixerol và các axit cacboxylic (còn g i là axit béo). M tỷ ấ ườ ượ ọ ặ
khác, khi đun nóng glixerol v i các axit béo, l i thu đc lipit. V y lipit (ch t béo) là este c a glixerol v i cácớ ạ ượ ậ ấ ủ ớ
axit béo.
Công th c c u t o phân t c a lipit có th vi t: (RCOO)ứ ấ ạ ử ủ ể ế 3C3H5
Trong phân t lipit, g c ancol ph i là glixerin, g c axit béo có th khác nhau. Các axit béo là axit no ho cử ố ả ố ể ặ
không no.
+ Glixerol là ancol đa ch c có công th c: Cứ ứ 3H5(OH)3
+ Axit béo là nh ng axit đn ch c, m ch không phân nhánh, có s C ch n ( t 12- 24 nguyên t C)ữ ơ ứ ạ ố ẵ ừ ử
M t s axit béo th ng g p: CHộ ố ườ ặ 3[CH2]16COOH hay C17H35COOH : Axit stearic
CH3[CH2]7CH=CH[CH2]7COOH hay C17H33COOH : Axit oleic
CH3[CH2]14COOH hay C15H31COOH : Axit panmitic
C17H31COOH hay CH3 – (CH2)4 – CH = CH – CH2 – CH – CH – (CH2)7 – COOH Axit linoleic
nCH3COOCH=CH2
to, xt, P CH-CH2
OOCCH3
n
Vinyl axetat Poli(vinyl axetat)
CH3COOH + C2H5OH CH3COOC2H5 + H2O
H+, to
4

Đi nhi u thì nh đng. làm nhi u thì quen cách!!!ề ớ ườ ề
V y công th c chung c a ch t béo là: ậ ứ ủ ấ
VD: (C17H35COO)3C3H5 Tristearoylglixerol ( Tristearin)
(C17H33COO)3C3H5 Trioleorylglixerol ( Triolein)
(C15H31COO)3C3H5 Tripanmitoylglixerol ( Tripanmitin)
(C17H31COO)3C3H5 Trilinoleorylglixerol ( Trilinolein)
b) Tính ch t v t lýấ ậ
- Là ch t l ng ho c r n, không tan trong n c, nh h n n c: Ch t béo l ng ch a các g c axit béo ch aấ ỏ ặ ắ ướ ẹ ơ ướ ấ ỏ ứ ố ư
no( g m d u th c v t: d u l c, v ng, đu nành, ôliu…), ch t béo r n ch a các g c axit béo no ( g m m đngồ ầ ự ậ ầ ạ ừ ậ ấ ắ ứ ố ồ ỡ ộ
v t: m l n, dê, bò, c u…)ậ ỡ ợ ừ
- D u m đ lâu th ng có mùi hôi, khét khó ch u g i là hi n t ng b ôi: Nguyên nhân là do liên k t đôi C=Cầ ỡ ể ườ ị ọ ệ ượ ị ế
trong g c axit không no c a ch t béo b oxi hóa ch m trong không khí t o thành peoxit, ch t này phân h y choố ủ ấ ị ậ ạ ấ ủ
các anđehit có mùi khó ch u. D u m sau khi rán cũng b oxi hóa thành anđehit, s d ng các lo i d u m nàyị ầ ỡ ị ử ụ ạ ầ ỡ
không đm b o v sinh an toàn th c ph m.ả ả ệ ự ẩ
c) Tính ch t hóa h cấ ọ : t ng t nh esteươ ự ư
- Th y phân este trong môi tr ng axit thu đc các axit béo và glixerol:ủ ườ ượ T ng t các este khác, tính ch t hoáươ ự ấ
h c quan tr ng nh t c a lipit là ph n ng thu phân.Có th đun nóng lipit v i n c có xúc tác, ho c đun nóngọ ọ ấ ủ ả ứ ỷ ể ớ ướ ặ
lipit v i n c trong n i kín áp su t cao (25at) và nhi t đ cao (220ớ ướ ồ ở ấ ệ ộ oC):Ph n ng trên có đc đi m thu nả ứ ặ ể ậ
ngh chị
ch t béo + Hấ2O
đSOH 42
axit béo + glixerol
(RCOO)3C3H5 + 3H2O
H
3RCOOH + C3H5(OH)3
H+, to
(C17H35COO)3C3H5 + 3H2O 3C17H35COOH + C3H5(OH)3
tristearin axit stearic glixerol
- Th y phân ch t béo trong môi tr ng ki m( Ph n ng xà phòng hóa) thu đc mu i c a axit béo (xàủ ấ ườ ề ả ứ ượ ố ủ
phòng) và glixerol. N u đun nóng ch t béo v i dung dich ki m s thu đc glixerin và h n h p mu i natri c aế ấ ớ ề ẽ ượ ỗ ợ ố ủ
các axit béo (g i la xà phòng). Ph n ng x y ra nhanh h n và m t chi uọ ả ư ả ơ ộ ề
ch t béo + NaOH ấ
o
t
mu i c a axit béo + glixerolố ủ
(RCOO)3C3H5 + 3NaOH
H
3RCOONa + C3H5(OH)3
(C15H31COO)3C3H5 + 3NaOH to 3C15H31COONa + C3H5(OH)3
tripanmitin Natri panmitat glixerol
( Dùng làm xà phòng)
- Ph n ng c ng Hả ứ ộ 2 c a ch t béo l ng:ủ ấ ỏ Đun nóng h n h p lipit l ng, có b t Ni xúc tác, trong n i kín và d nỗ ợ ỏ ộ ồ ẫ
vào đó dòng khí hidro có áp su t cao s x y ra hi n t ng ph n ng c ng hidro vào g c axit béo không no.ấ ẽ ả ệ ưọ ả ứ ộ ố
K t qu là sau ph n ng thu đc lipit tr ng thái r n. Ph ng pháp này đc dung trong công nghi p đ bi nế ả ả ứ ượ ở ạ ắ ươ ượ ệ ể ế
m t s d u thành m r n, ho c b nhân t o có gí tr s d ng cao h n.ộ ố ầ ỡ ắ ặ ơ ạ ị ử ụ ơ
(C17H33COO)3C3H5 + 3H2 Ni, to (C17H35COO)3C3H5
Triolein tristearin
Ch t béo ấl ngỏ ch a g c HC không no (d u) + Hứ ố ầ 2
o
tNi,
ch t béo ấr nắ ch a g c HC no (m )ứ ố ỡ
triolein (C17H33COO)3C3H5 + 3H2
o
tNi,
(C17H35COO)3C3H5 tristearin
M= 884 M= 890
L U Ý :Ư Cho n axit béo tác d ng v i glixerol thì s trieste thu đc là: ụ ớ ố ượ
2
)1(
2
nn
2 axit béo 6 trieste ; 3 axit béo 18 trieste
Chú ý:
- Ch s axit là s miligam KOH dùng đ trung hoà axit t do có trong 1 gam ch t béo.ỉ ố ố ể ự ấ
R1COOCH2
hay (RCOO)3C3H5Trong đó R, R1, R2, R3 là các g c hiđrocacbon gi ng ho c khác ố ố ặ
nhau
R2COOCH
R3COOCH2
5





![Bài tập so sánh hơn và so sánh nhất của tính từ [kèm đáp án/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250808/nhatlinhluong27@gmail.com/135x160/77671754900604.jpg)
![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)




![Tài liệu Lý thuyết và Bài tập Tiếng Anh lớp 6 [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250802/hoihoangdang@gmail.com/135x160/18041754292798.jpg)




