1
1
CHƯƠNG 1: NGUYÊN LÝ 1 NHIỆT
ĐỘNG HỌC – NHIỆT HÓA HỌC
1.1. Một số khái niệm
1.2. Công và nhiệt
1.3. Nguyên lý I nhiệt động học
1.4. Nhiệt dung
1.5. Định luật HESS
1.6. Định luật KIRCHHOFF
2
1.1.1. HỆ
a. Khái niệm: Hệ là một phần vật chất có giới hạn xác
định đang được khảo sát về phương diện trao đổi
năng lượng và vật chất. Phần còn lại của hệ là môi
trường ngoài đối với hệ.
b. Ví dụ: Hệ gồm kim loại kẽm đang cho phản ứng với
dung dịch HCl trong một becher:
Zn + 2 HCl = ZnCl2 + H2
1.1 MỘT SỐ KHÁI NIỆM
3
c. Phân loại:
- Hệ hở (hệ mở): là hệ có
thể trao đổi cả năng
lượng lẫn vật chất với
môi trường ngoài.
1.1.1. HỆ
1.1 MỘT SỐ KHÁI NIỆM
4
- Hệ kín (hệ đóng): là hệ chỉ trao đổi với môi trường
ngoài năng lượng nhưng không trao đổi vật chất.
Hệ kín
1.1.1. HỆ
1.1 MỘT SỐ KHÁI NIỆM
c. Phân loại:

2
5
- Hệ cô lập: là hệ không trao
đổi cả năng lượng lẫn vật
chất với môi trường ngoài.
1.1.1. HỆ
1.1 MỘT SỐ KHÁI NIỆM
c. Phân loại:
6
- Hệ đoạn nhiệt: là hệ không trao đổi chất và nhiệt
nhưng có thể trao đổi công với mơi trường ngoài.
1.1.1. HỆ
1.1 MỘT SỐ KHÁI NIỆM
c. Phân loại:
7
- Pha: là tập hợp những phần đồng nhất của hệ có
cùng tính chất lý, hóa ở mọi điểm, có cùng thành
phần hóa học và được tách biệt với các phần khác
bằng bề mặt phân chia pha.
+ Hệ đồng thể: là hệ chỉ có một pha.
+ Hệ dị thể: là hệ có từ 2 pha trở lên.
1.1.1. HỆ
1.1 MỘT SỐ KHÁI NIỆM
Phân loại theo trạng thái:
8
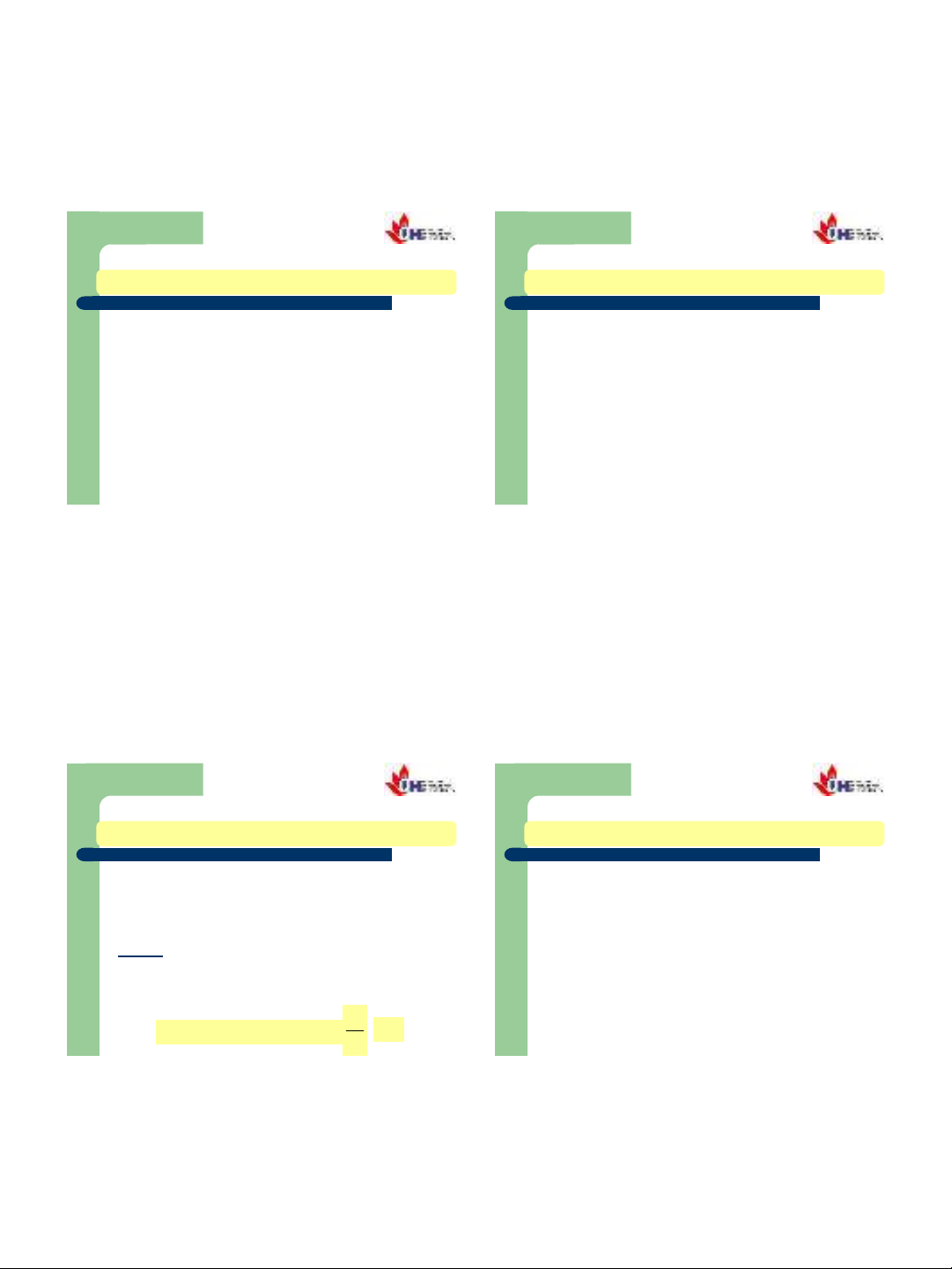
Trạng thái là một từ nói lên đặc điểm của hệ
đang được khảo sát, là tập hợp tất cả những tính
chất nhiệt động của hệ.
Chất phản ứng Sản phẩm
DH2
DH3
DH1
1.1.2. TRẠNG THÁI
1.1 MỘT SỐ KHÁI NIỆM
3
9
a. Thông số (biến số) trạng thái: là những đại
lượng vật lý đặc trưng cho tính chất nhiệt động của
hệ như: nhiệt độ, áp suất, thể tích, nhiệt dung
riêng, nội năng, khối lượng…
Hệ có trạng thái xác định khi những thông số
trạng thái của hệ xác định.
Trạng thái của hệ sẽ thay đổi nếu ít nhất có một
trong những biến số trạng thái thay đổi.
1.1.2. TRẠNG THÁI
1.1 MỘT SỐ KHÁI NIỆM
10
Có 2 loại thông số trạng thái:
Thông số cường độ: là những thông số không
phụ thuộc lượng chất.
Ví dụ: nhiệt độ, áp suất, nhiệt dung …
Thông số dung độ (khuếch độ): là những thông
số phụ thuộc vào lượng chất.
Ví dụ: Khối lượng, thể tích, nội năng…
1.1.2. TRẠNG THÁI
1.1 MỘT SỐ KHÁI NIỆM
11 pv = nRT hay pv =
M
m
RT
1.1 MỘT SỐ KHÁI NIỆM
b. Hàm trạng thái: là các đại lượng đặc trưng cho
mỗi trạng thái của hệ, thường có thể biễu diễn
dưới dạng một hàm số của thông số trạng thái
Lưu ý: Hàm trạng thái chỉ phụ thuộc vào trạng
thái đầu và cuối của hệ, không phụ thuộc vào
các trạng thái trung gian.
Ví dụ:
1.1.2. TRẠNG THÁI
12
Quá trình là tập hợp các giai đoạn biến đổi để
chuyển hệ từ trạng thái này sang trạng thái khác.
Sự thay đổi dù chỉ một thông số trạng thái cũng
kèm theo sự thay đổi trạng thái của hệ và thực
hiện một quá trình.
Nếu sau một số biến đổi mà hệ lại trở về trạng thái
ban đầu thì gọi là quá trình kín hay chu trình.
1.1.3. QUÁ TRÌNH
1.1 MỘT SỐ KHÁI NIỆM
4
13
Nhiệt (nhiệt năng): sự chuyển năng lượng có liên
quan đến sự thay đổi cường độ chuyển động phân
tử của hệ. Ký hiệu là Q (cal hoặc J).
Công: sự chuyển năng lượng có liên quan đến sự
chuyển dịch những khối lượng vật chất vĩ mô dưới
tác dụng của những lực nào đó. Ký hiệu là A hay
W (cal hoặc J).
1.2 NHIỆT VÀ CÔNG
14
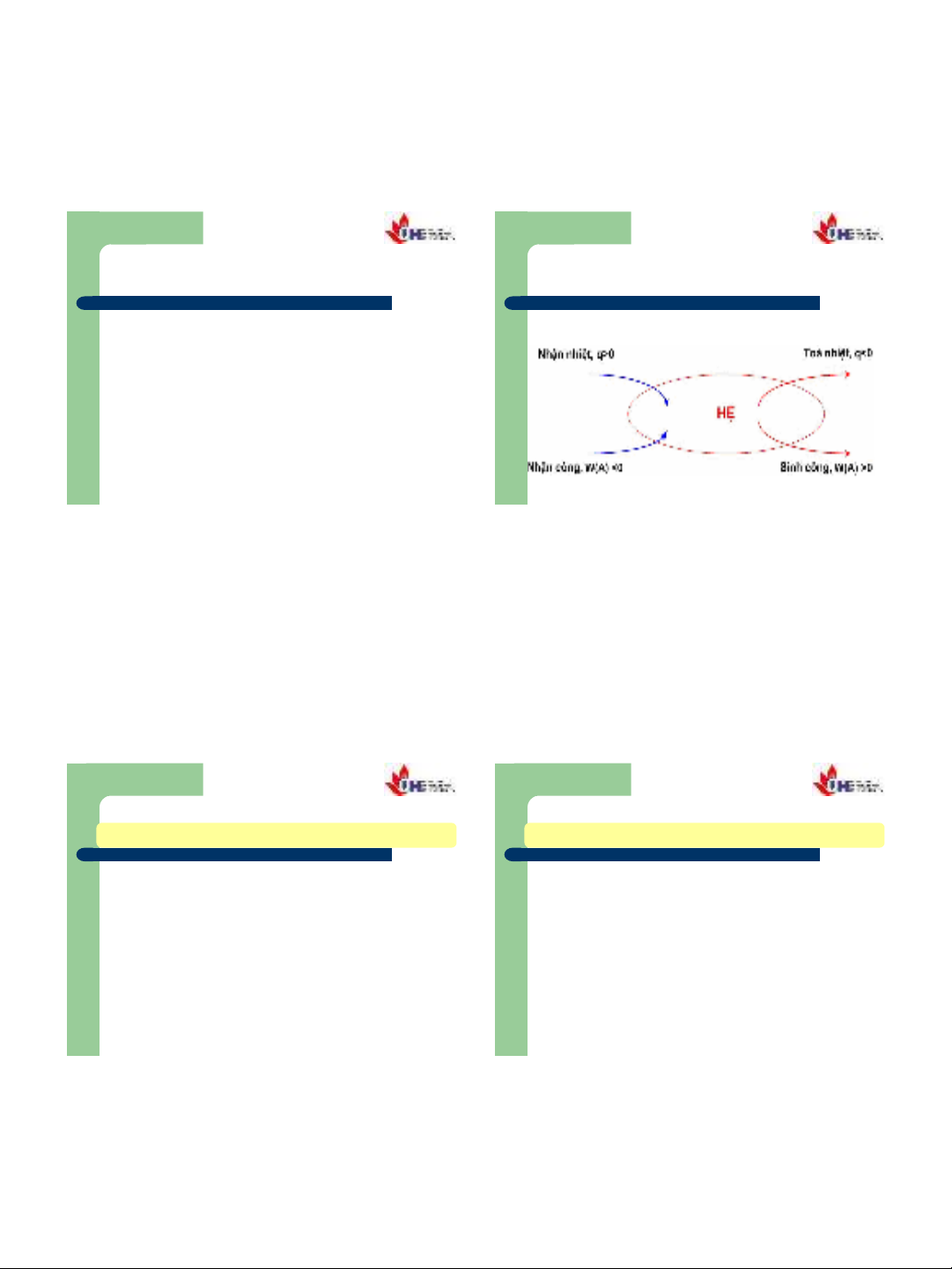
Quy ước dấu của công và nhiệt
Nếu hệ tỏa nhiệt thì nhiệt có trị số âm, Q < 0.
Nếu hệ thu nhiệt thì nhiệt có trị số dương, Q > 0.
Nếu hệ sinh công thì công có trị số dương, A > 0.
Nếu hệ nhận công thì công có trị số âm, A < 0.
1.2 NHIỆT VÀ CÔNG
15
Lượng nhiệt năng Q cần dùng để đưa m gam
hóa chất tăng lên một khoảng nhiệt độ tương đối
nhỏ từ T1 đến T2 là:
Q = mc(T2 - T1)
Trong đó: c là nhiệt dung riêng (cal/g.K hoặc J/g.K)
1.2 NHIỆT VÀ CÔNG
1.2.1. NHIỆT
16
(Dùng ký hiệu δA vì công A không phải là một
hàm số trạng thái, nó thay đổi tùy theo đường
quá trình)
1.2 NHIỆT VÀ CÔNG
1.2.2. CÔNG
δA = P.dV ⟹ A =
P.dV
2
1
5
17
Nội năng của hệ là năng lượng dự trữ ở bên trong
hệ, do:
- Ðộng năng chuyển động phân tử: tịnh tiến, quay,
dao động.
- Năng lượng tương tác giữa các phân tử: hút, đẩy.
- Năng lượng các điện tử trong phân tử.
- Năng lượng dự trữ của hạt nhân nguyên tử...
1.3 NGUYÊN LÝ I NHIỆT ĐỘNG HỌC
1.3.1. NỘI NĂNG
18
Nội năng được ký hiệu là U (cal hoặc J)
Biến thiên nội năng: DU = U2 – U1
(U2 và U1 lần lượt là trị số của U ở trạng thái cuối và
trạng thái đầu của hệ)
Nội năng U là hàm trạng thái nên chỉ phụ thuộc
vào trạng thái đầu và trạng thái cuối chứ không phụ
thuộc vào các trạng thái trung gian.
1.3 NGUYÊN LÝ I NHIỆT ĐỘNG HỌC
1.3.1. NỘI NĂNG
19
Phát biểu: Biến thiên nội năng của hệ bằng lượng
nhiệt mà hệ nhận trừ đi công mà hệ sinh ra.
Biểu thức toán học: DU = Q - A
Trong đó:
- Q và A là nhiệt và công trao đổi giữa hệ với môi trường
ngoài theo bất cứ đường quá trình nào để hệ đi từ trạng
thái đầu đến trạng thái cuối.
Ứng với quá trình nhỏ, ta có: dU = Q - A
1.3 NGUYÊN LÝ I NHIỆT ĐỘNG HỌC
1.3.2. NGUYÊN LÝ I NHIỆT ĐỘNG HỌC
20
a. Quá trình đẳng tích: (V = const hay dV = 0)
Do quá trình là đẳng tích nên công thể tích không
thực hiện được: A = 0
Theo nguyên lý I: QV = ΔU
Vậy: nhiệt mà hệ nhận được trong quá trình đẳng
tích bằng với biến thiên nội năng của hệ.
1.3 NGUYÊN LÝ I NHIỆT ĐỘNG HỌC
1.3.3. ÁP DỤNG NGUYÊN LÝ I