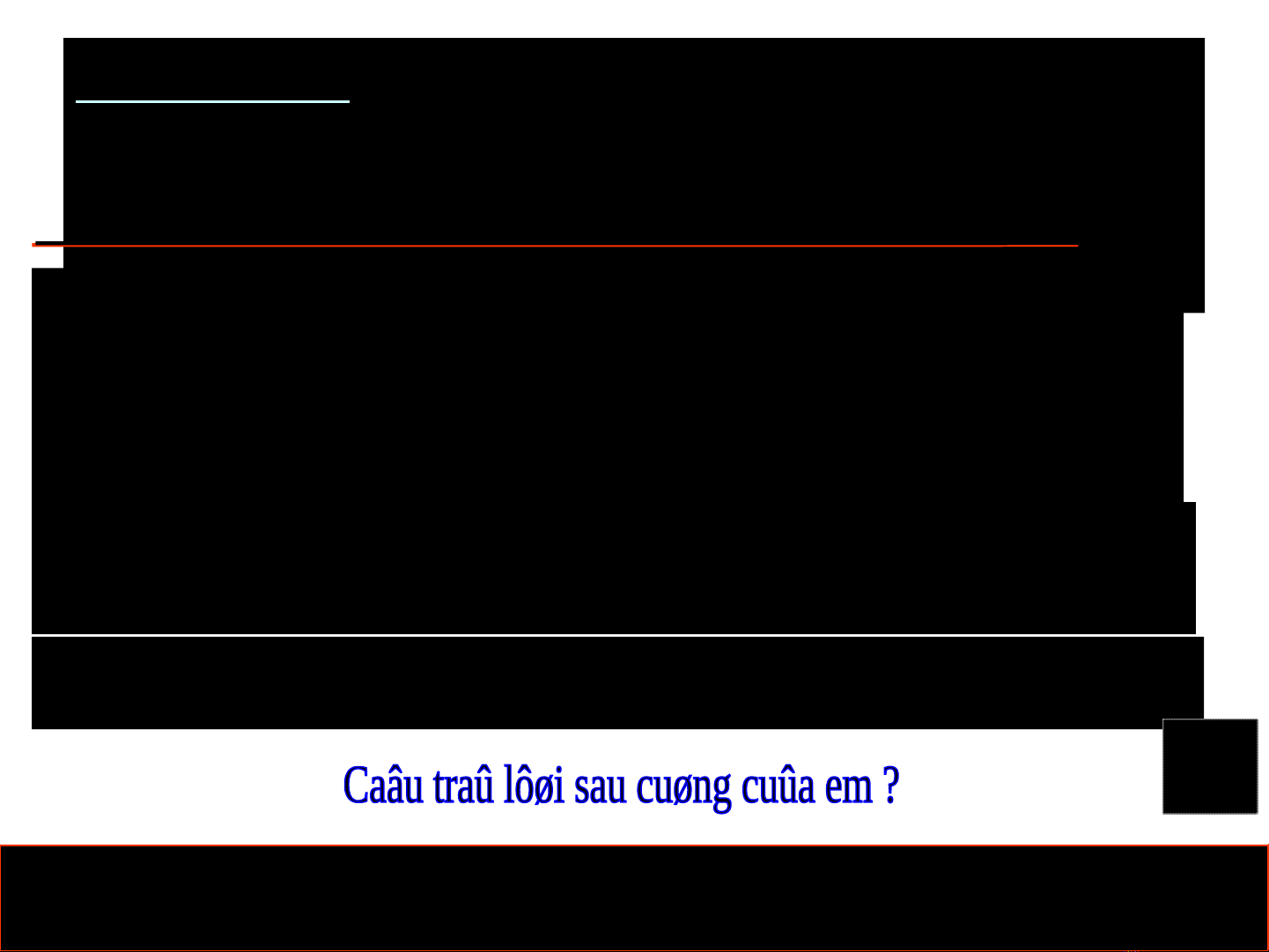
Caâu hoûi 1 : Cho 5,6 gam saét taùc duïng
vôùi dung dòch H2SO4 4M ôû nhieät ñoä
thöôøng. YÙ naøo sau ñaây ñuùng ? Toác
ñoä phaûn öùng taêng khi :
A. Duøng dung dòch H2SO4 2M thay dung
dòch H2SO4 4M
B. Taêng theå tích dung dòch H2SO4 4M
leân gaáp ñoâi.
C. Giaûm theå tích dung dòch H2SO4 4M
xuoáng moät nöûa.
D. Taêng nhieät ñoä phaûn öùng laø 50oC.
Caâu B

Caâu hoûi 2 : Moät phaûn öùng hoùa hoïc
ñöôïc bieåu dieãn nhö sau ; Chaát phaûn
öùng → saûn phaåm phaûn öùng. Yeáu toá
naøo sau ñaây khoâng aûnh höôûng ñeán
toác ñoä phaûn öùng ?
A. Noàng ñoä caùc chaát phaûn öùng.
B. Noàng ñoä caùc saûn phaåm.
C. Chaát xuùc taùc.
D. Nhieät ñoä.
Caâu B

GV gi¶ng d¹y: VE¬ng ThÞ PhE¬ng
Th¶o




























