BÀI GIẢNG VẬT LIỆU KỸ THUẬT ĐIỆN – ĐIỆN TỬ Trang 33
Chương 2: VẬT LIỆU BÁN DẪN
CHƯƠNG 2: VẬT LIỆU BÁN DẪN (VLBD)
2.1 Các quá trình vật lý trong VLBD và các tính chất của chúng
2.1.1 Các khái niệm cơ bản về bán dẫn
Vùng năng lượng trong chất rắn
Chất rắn được coi như cấu tạo bởi một tập hợp các nguyên tử. Trong vật rắn tinh thể
các nguyên tử được sắp xếp một cách tuần hoàn trong mạng tinh thể, để khảo sát
vấn đề một cách khái quát ta hãy xét mạng tinh thể gồm những nguyên tử giống
nhau. Khi khoảng cách giữa các nguyên tử lớn, các nguyên tử được coi là độc lập:
không tương tác với nhau. Mỗi nguyên tử có mức năng lượng gián đoạn cho phép,
giống như trong trường hợp chỉ có một nguyên tử đơn độc. Trong số các mức năng
lượng đó có một số mức bị chiếm bởi electron. Ở trạng thái cơ bản electron chỉ
chiếm những mức năng lượng thấp nhất. Khi chỉ có 1 nguyên tử cô lập ứng với mỗi
giá trị lượng tử n chỉ có duy nhất 1 mức năng lượng, 1 quĩ đạo . Khi khoảng cách
giữa các nguyên tử giảm đến một giá trị nào đó, các nguyên tử có tương tác với
nhau thì sự chuyển động của electron không những chịu ảnh hưởng của hạt nhân
nguyên tử của nó mà còn chịu ảnh hưởng của các nguyên tử khác trong mạng tinh
thể. Khi có 2 nguyên tử tương tác với nhau thì sự chuyển động của hai electron của
hai nguyên tử đó chịu ảnh hưởng của cả hai hạt nhân của hai nguyên tử, để thoả
mãn nguyên lý Pauli hai electron phải ở hai trạng thái khác nhau, do đó mỗi mức
năng lượng cũ bây giờ bị tách thành 2 mức năng lượng. Nếu hệ chứa N nguyên tử
thì mỗi mức năng lượng trong nguyên tử cô lập sẽ tách thành N mức. Các mức này
rất sát nhau tạo thành vùng năng lượng cho phép. Trong 1 cm3 có khoảng 1022
nguyên tử, mỗi mức năng lượng sẽ tách thành 1 số rất lớn, mà độ rộng của một
vùng năng lượng khoảng một vài eV, do đó khoảng cách giữa các mức nhỏ trong
vùng năng lượng khoảng 10-22eV, có thể nói sự biến thiên năng lượng trong một
vùng năng lượng gần như liên tục. Giữa các vùng năng lượng là các vùng trống (gọi
là vùng cấm) mà trong đó không thể tồn tại bất kỳ trạng thái nào của electron.
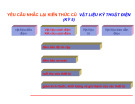
Khi số lượng electron và số nguyên tử tăng lên thì số mức được tách ra từ 1 mức
tăng lên theo, tạo thành vùng năng lượng cho phép. Những electron ở vòng quĩ đạo
ngoài cùng chịu ảnh hưởng tương tác nhiều nhất, do đó có vùng năng lượng rộng
nhất. Đối với electron trong cùng, ảnh hưởng tương tác nhỏ nhất nên vùng năng
lượng hẹp nhất, thậm chí không thể phân biệt với mức năng lượng của nguyên tử cô
lập. (Hình 2.1)
Bề rộng của vùng năng lượng phụ thuộc vào khoảng cách giữa các nguyên tử tức là
phụ thuộc vào cấu trúc tinh thể.
Số trạng thái trong mỗi vùng lại phụ thuộc vào số lượng nguyên tử tức là phụ thuộc
vào độ lớn nguyên tử.
Những vùng gần nhau có thể phủ lên nhau, nếu khoảng cách này lớn thì các vùng
năng lượng sẽ cách xa nhau và có thể ngăn cách bằng vùng cấm.
BÀI GIẢNG VẬT LIỆU KỸ THUẬT ĐIỆN – ĐIỆN TỬ Trang 34
Chương 2: VẬT LIỆU BÁN DẪN
Hình 2.1 Sự hình thành vùng năng lượng trong chất rắn
Cấu trúc vùng năng lượng trong VLBD
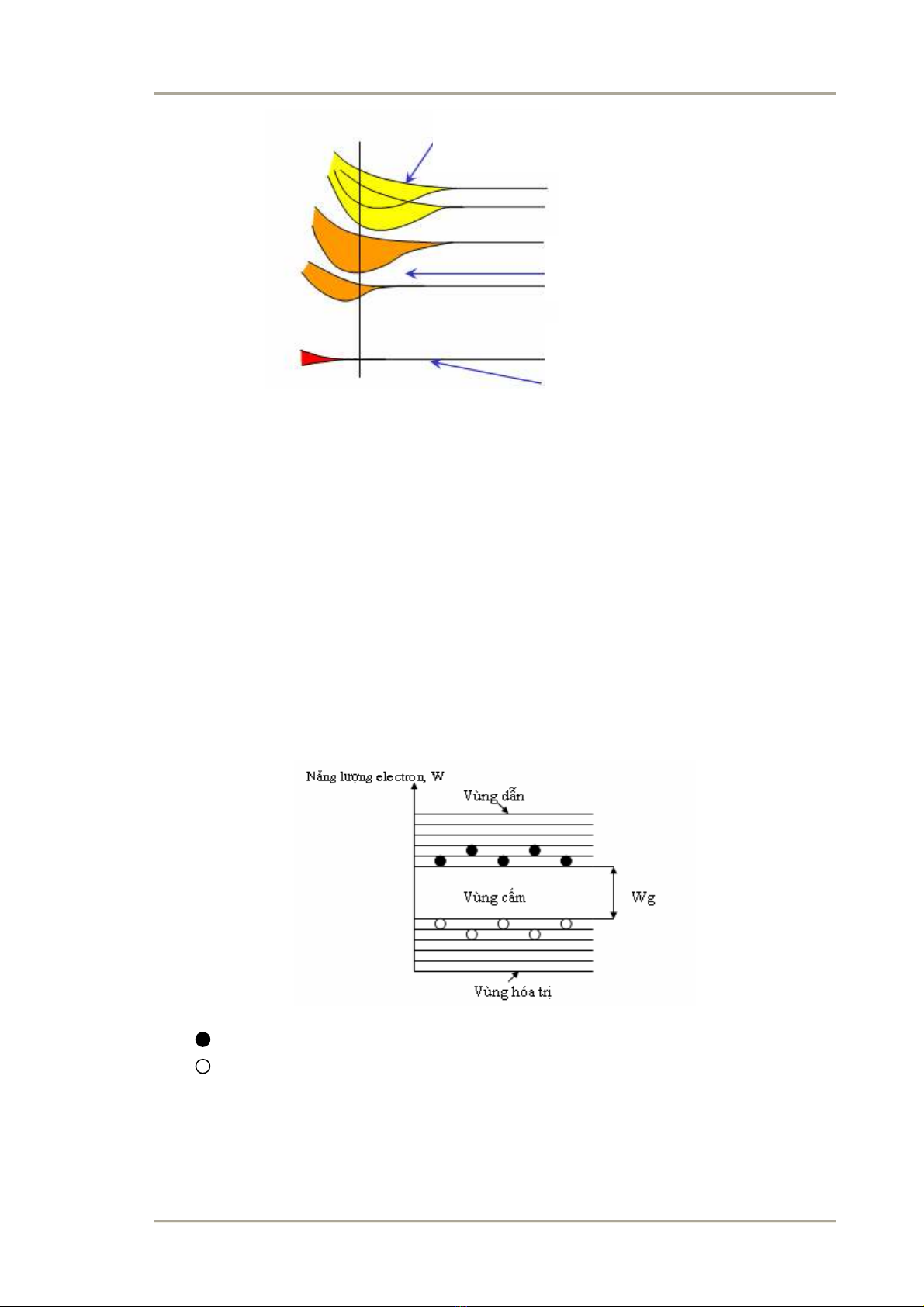
Các vùng năng lượng trong chất rắn có thể bị chiếm đầy, chiếm một phần hay bỏ
trống. Vùng năng lượng cao nhất bị chiếm bởi electron hóa trị và vùng cao hơn
quyết định tính dẫn điện của chất rắn. Vùng hóa trị chứa nhiều điện tử bị chiếm đầy
và vùng phía trên tiếp ngay sau đó là vùng dẫn. Ở vật liệu dẫn điện vùng dẫn không
được điền đầy. Các electron dễ dàng bị chuyển từ vùng hoá trị lên mức năng lượng
cao hơn trở thành electron tự do và tham gia vào quá trình dẫn điện.
Ở vật liệu cách điện vùng hóa trị bị chiếm đầy, vùng cấm có giá trị lớn cỡ vài eV,
do vậy các electron khó có khả năng vượt qua vùng cấm để tham gia dẫn điện.
Ở vật liệu bán dẫn điện cấu trúc vùng năng lượng tương tự như vật liệu cách điện
nhưng vùng cấm hẹp hơn cỡ 0,1eV đến 1 eV. Ở 00K chúng là chất cách điện. Ở
nhiệt độ trong phòng các electron có thể thu được năng lượng nhiệt đủ lớn để
chuyển lên vùng dẫn và tham gia vào quá trình dẫn điện. Điều khác nhau giữa sự
dẫn điện của kim loại và bán dẫn là khi các electron chuyển lên vùng dẫn thì đồng
thời tạo ra ở vùng hóa trị các lỗ trống (Hình 2.2).
Hình 2.2 Cấu trúc vùng năng lượng trong VLBD.
: Electron tự do trong vùng dẫn
: Lỗ trống trong vùng hóa trị
Do đó, các electron trong vùng hóa trị có thể chuyển động đến các lỗ trống để lấp
đầy tạo ra sự chuyển động của các lỗ trống đó là dòng các lỗ trống mang điện tích
dương.
Mức thấp nhất trong vùng dẫn ứng với năng lượng của electron đứng yên hay chính
là thế năng của electron, do đó đáy vùng dẫn tương ứng với thế năng của electron,
Electron
trong cùng
Vùng năng lượng
cách xa nhau
Vùng năng lượng
phủ lên nhau

BÀI GIẢNG VẬT LIỆU KỸ THUẬT ĐIỆN – ĐIỆN TỬ Trang 35
Chương 2: VẬT LIỆU BÁN DẪN
tương tự như đỉnh vùng hoá trị là ứng với thế năng của lỗ trống. Nếu electron ở mức
năng lượng cao hơn WC hoặc nếu lỗ trống ở mức năng lượng thấp hơn WV thì các
electron và lỗ trống này có động năng bằng hiệu giữa các mức năng lượng của
chúng và năng lượng ứng với đáy vùng dẫn hoặc đỉnh vùng hóa trị. (Hình 2.3)
Hình 2.3 Đáy vùng dẫn tương ứng với thế năng của electron
*Phân loại VLBD
Vật liệu bán dẫn sử dụng trong thực tế có thể chia ra bán dẫn đơn giản, bán dẫn hợp
chất hóa học và bán dẫn phức tạp (bán dẫn gốm). Hiện tại đã nghiên cứu bán dẫn từ
trường và bán dẫn lỏng.
Tất cả có khoảng 10 loại bán dẫn đơn giản
Nguyên tố Thuộc nhóm (bảng tuần hoàn Menđêlêev)
Bo III
Silic IV
Giecmani IV
Phốtpho V
Asen V
Lưu huỳnh VI
Sêlen VI
Têlua VI
Iốt VII
Các chất giecmani, silic và sêlen có ý nghĩa quan trọng trong kỹ thuật hiện đại.
Bán dẫn hợp chất hóa học là hợp chất của các nguyên tố thuộc các nhóm khác nhau
trong bảng hệ thống tuần hoàn Menđêlêev tương ứng với dạng tổng quát
AIV BIV (SiC) A III BV(InSb,GaAs) và một số chất có thành phần phức tạp.(Các
VLBD liên kết như GaAs, ký hiệu chung AIIIBV, chỉ sự liên kết của nguyên tố có
hoá trị III là Ga với nguyên tố có hóa trị V là As )
*Cấu trúc tinh thể của VLBD
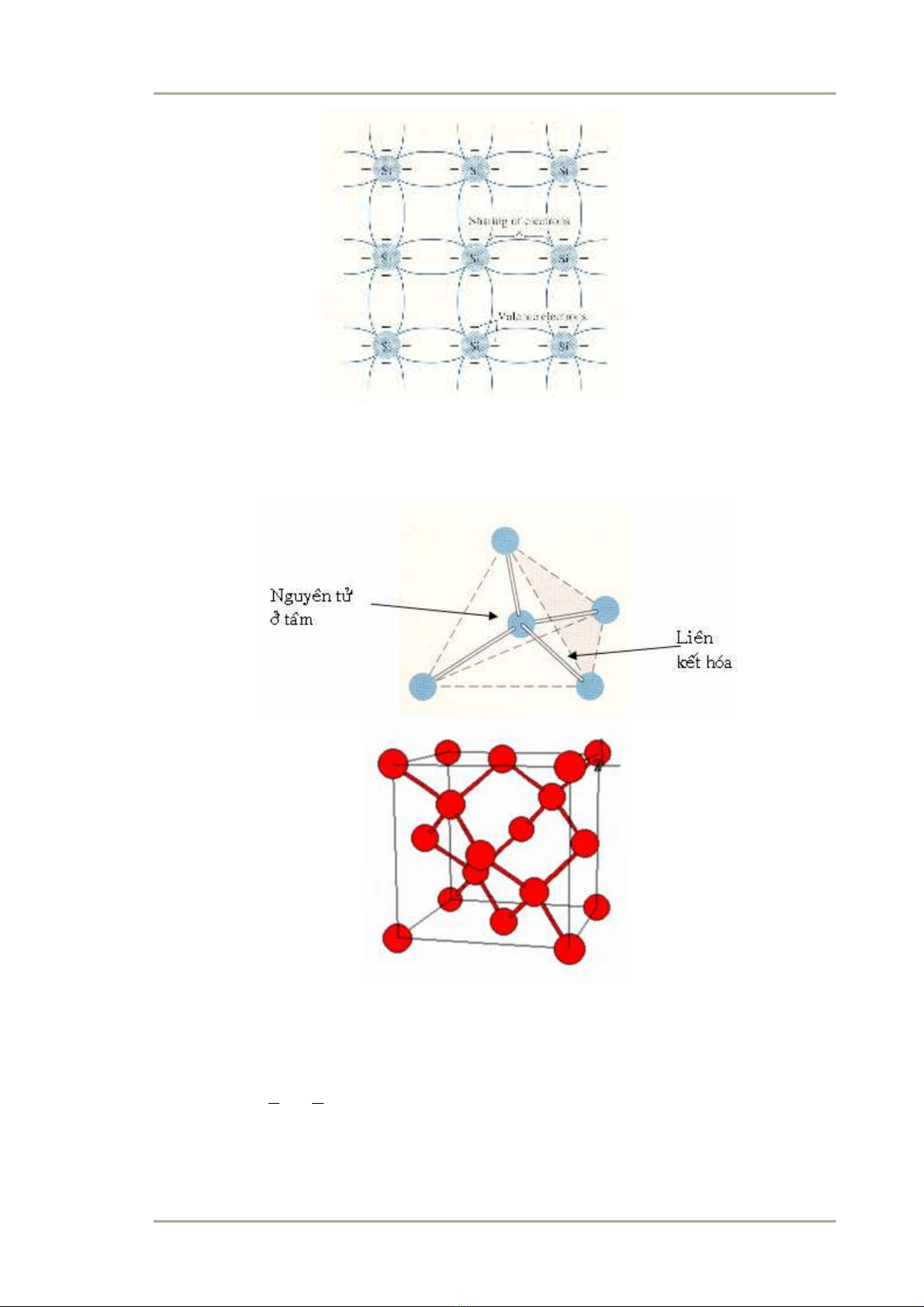
Khảo sát 2 VLBD chính là Silic và germani: Tính chất chung trong cấu tạo nguyên
tử của chúng là có 4 electron hóa trị ở trên phân lớp ngoài. Giữa các nguyên tử Silic
(germani) có sự liên kết đồng hóa trị, mỗi nguyên tử liên kết với 4 nguyên tử xung
quanh bằng cách trao đổi electron chung với nhau. (Hình 3.4)
BÀI GIẢNG VẬT LIỆU KỸ THUẬT ĐIỆN – ĐIỆN TỬ Trang 36
Chương 2: VẬT LIỆU BÁN DẪN
Hình 2.4 Sơ đồ trải phẳng một chiều của mạng tinh thể Silic
Cấu trúc tinh thể của Silic, Germani trong mạng không gian ba chiều là cấu trúc kim
cương. Gồm 2 lập phương diện tâm lồng vào nhau, cách nhau ¼ đường chéo trong
không gian.
Hình 2.5
Số nguyên tử Silic trong lập phương
46.
2
1
8.
8
1=+
Mật độ nguyên tử Silic trong tinh thể
a/ Ô cơ bản
b/ Cấu trúc tinh thể của Si, Ge,
cấu trúc kim cươn
g
BÀI GIẢNG VẬT LIỆU KỸ THUẬT ĐIỆN – ĐIỆN TỬ Trang 37
Chương 2: VẬT LIỆU BÁN DẪN
3
4.2
a
Nsi =
Hằng số tinh thể của Silic là:
a= 5,43 A0
Vậy: N (Silic) = 4,997. 1022 nguyên tử/ cm3
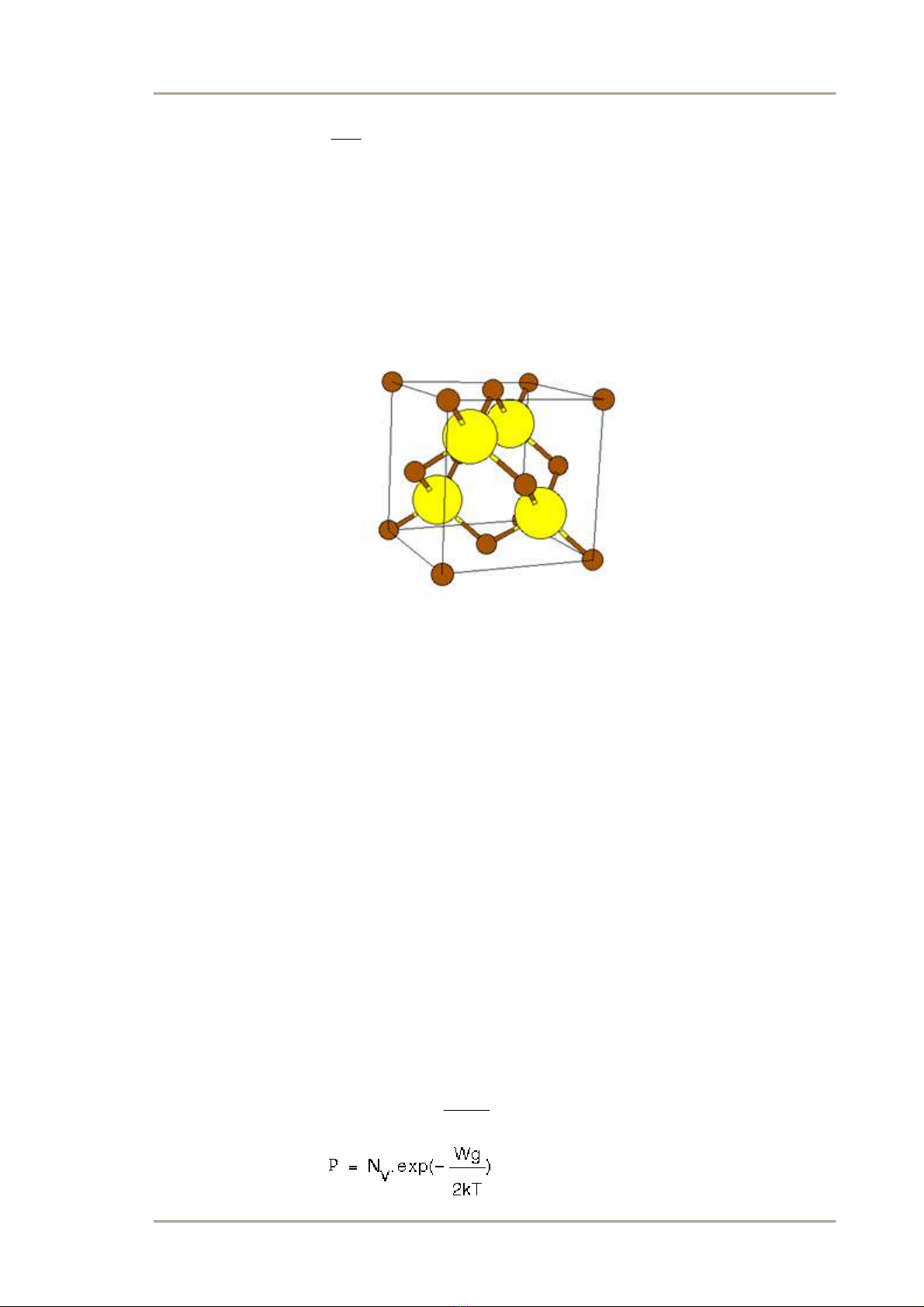
Nếu 2 nguyên tử trong ô cơ bản khác nhau thì cấu trúc gọi là cấu trúc Sfalerit (hay
blenzo kẽm). Các VLBD: GaAs, AlAs, CdS … thuộc cấu trúc này. GaAs có cấu
trúc tinh thể sfalerit ô cơ bản có 2 nguyên tử. Trong đó 1 là Ga, còn 1 là As. Bốn
nguyên tử As bao quanh 1 nguyên tử Gali, 4 nguyên tử Ga bao quanh 1 nguyên tử
Asen.
Hình 2.6 Cấu trúc tinh thể Sfalerit của GaAs
*VLBD tinh khiết
Ở nhiệt độ T=00K không có electron nào ở vùng hóa trị có đủ năng lượng bằng năng
lượng vùng cấm Wg để nhảy lên vùng dẫn, để VLBD có thể dẫn điện. Ở nhiệt độ
này VLBD không có tính dẫn điện giống như điện môi lý tưởng.
Khi T>0 tồn tại một xác suất có một số electron do nhận được năng lượng nhiệt sẽ
vượt qua vùng cấm để có mặt ở vùng dẫn, trở thành electron tự do. Như vậy sẽ tạo
thành một số lỗ trống ở vùng hóa trị, do các lỗ trống này mà electron ở vùng hóa trị
sẽ tham gia vào quá trình dẫn điện. Bản chất của sự chuyển động của các lỗ trống
này có thể hình dung như sự chuyển động của các điện tích dương với một giá trị
khối lượng hiệu dụng nào đó. Sự chuyển động của electron tự do trong miền dẫn dễ
dàng hơn sự chuyển động của lỗ trống trong vùng hóa trị. Nói cách khác, tính linh
động của electron ( n
μ) trong vùng dẫn lớn hơn tính linh động của lỗ trống ( p
μ
)
trong vùng hóa trị. (Đối với Germani n
μ
= 0,38 m2/Vs, p
μ
= 0,18 m2/Vs)
Điện dẫn suất của VLBD xác định như sau: pn pn
μ
μ
σ
+
=
n, p là mật độ electron và lỗ trống (cm-3) trong VLBD.
VLBD tinh khiết là VLBD có thể bỏ qua ảnh hưởng của tạp chất trong nó. Trong
VLBD tinh khiết có bao nhiêu electron tự do thì có bấy nhiêu lỗ trống.
Do vậy: n = p = ni
Có thể tính được: )
kT2
Wg
exp(Nn C−=

![Tài liệu đặc tính kỹ thuật dây đồng trần xoắn [C] chuẩn nhất](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250808/trinhvanmotnt@gmail.com/135x160/21161754899208.jpg)