
8.1. Nguyên tử Hiđro
8.2. Nguyên tử kim loại kiềm (biểu thức năng lượng, các dãy vạch
quang phổ)
8.3. Mômen động lượng quỹ đạo và mômen từ quỹ đạo của electron.
Hiệu ứng Zeeman
8.4. Spin của electron
Chương 8
NGUYÊN TỬ
8.1. Nguyên tử Hiđro
1. Phương trình Schrodinger và nghiệm (thừa nhận) cho electron trong
nguyên tử Hiđro
+
-
e
x
y
z
0
r
r
e
U
0
2
4
),,r(
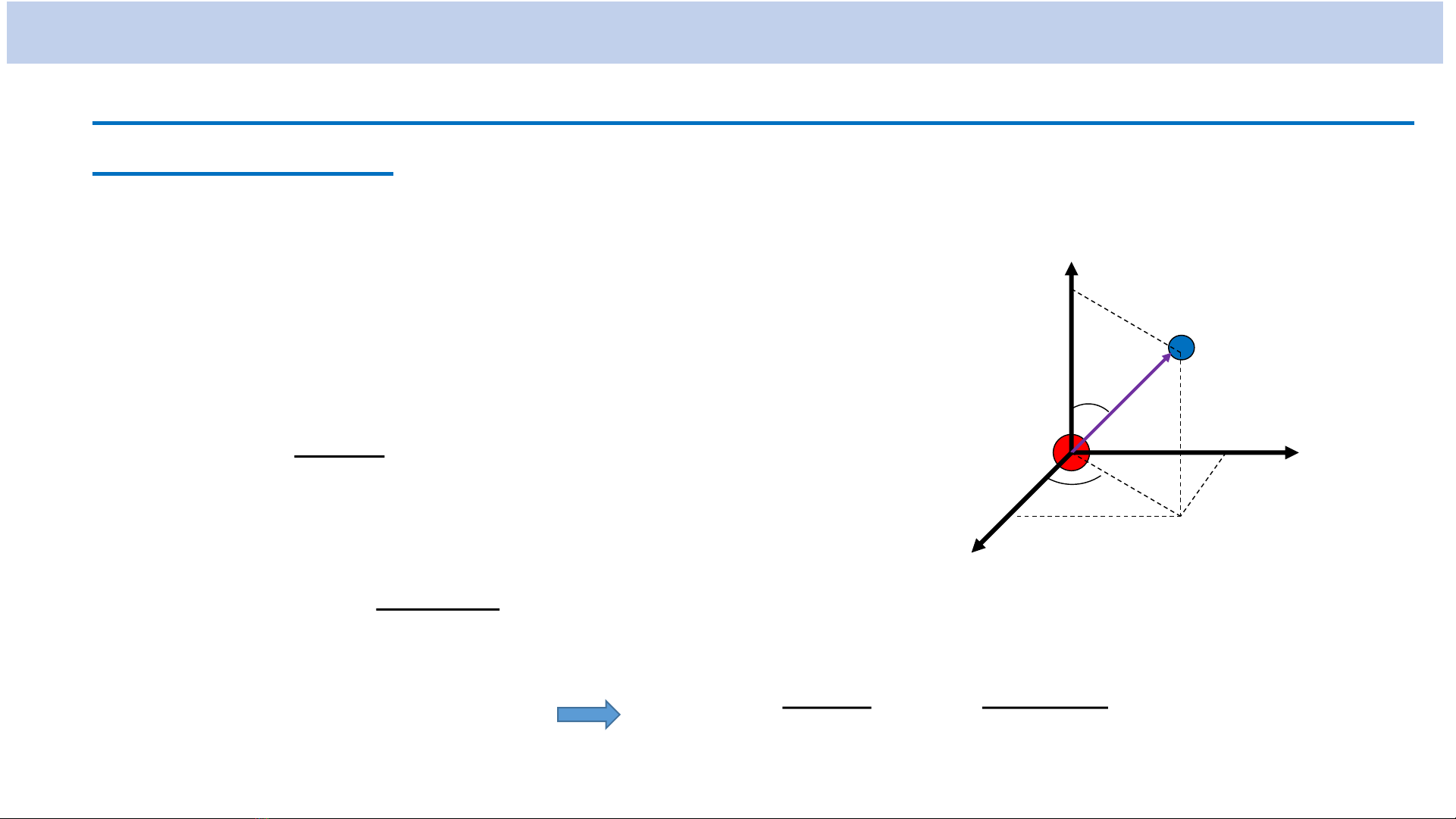
Xét chuyển động của electron trong
nguyên tử Hiđro. Hàm sóng 𝝍của electron
là nghiệm của phương trình Schrodinger
0)
4
(
2
0
2
2
r
e
E
me
0))((
2
2
rUE
me
Với
(*)
8.1. Nguyên tử Hiđro
1. Phương trình Schrodinger và nghiệm (thừa nhận) cho electron trong
nguyên tử Hiđro
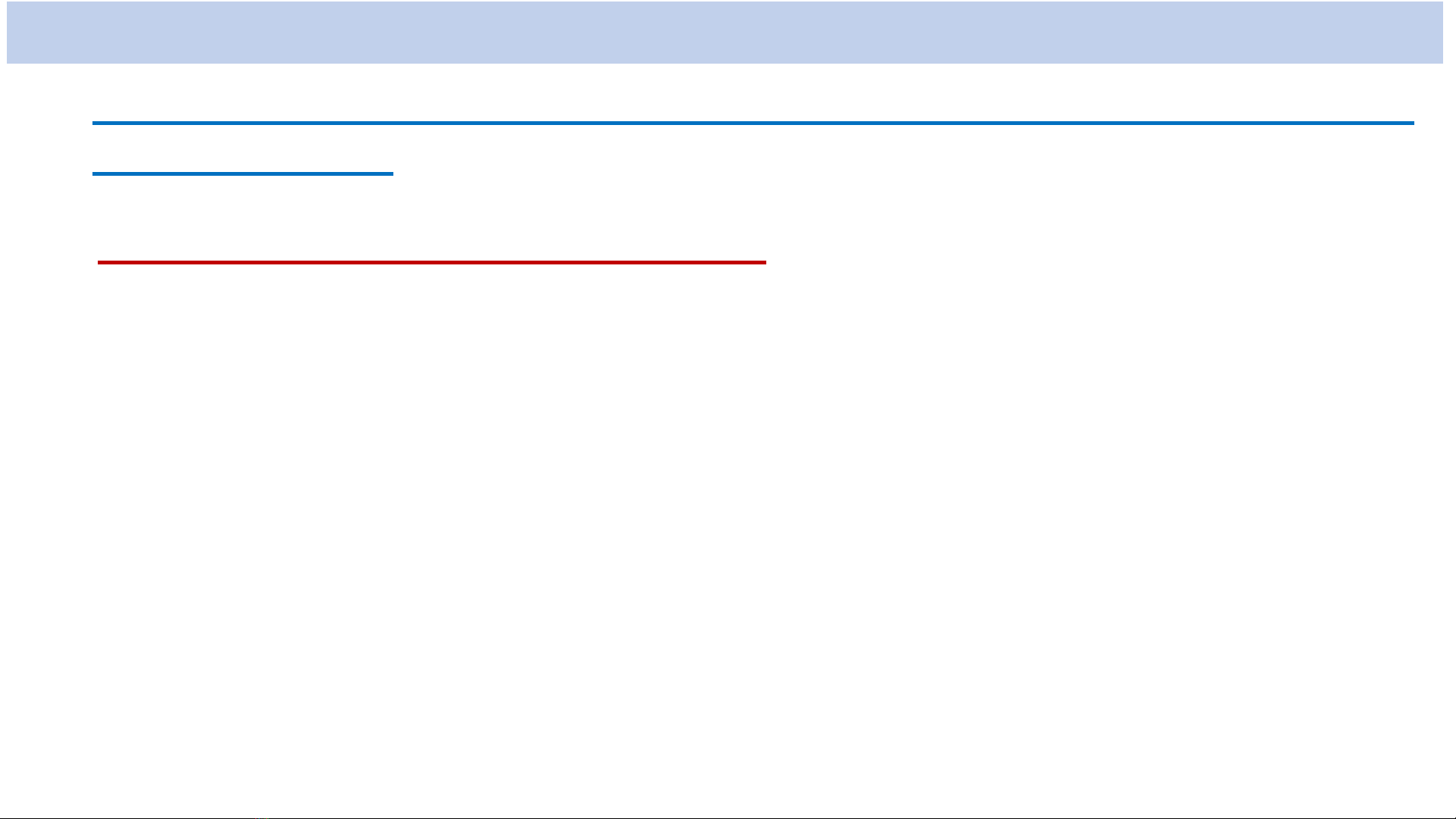
Giải phương trình Schrodinger ta có:
* Hàm sóng 𝝍của electron trong nguyên tử Hiđro:
𝒍= 0, 1, 2, ..., n-1: số lượng tử quỹ đạo
),()(),,(
lmnlnlm YrRr
lm ,...,2,1,0
: số lượng tử từ
n = 1, 2, 3, ...: số lượng tử chính
Trong đó
1. Phương trình Schrodinger và nghiệm (thừa nhận) cho electron trong
nguyên tử Hiđro
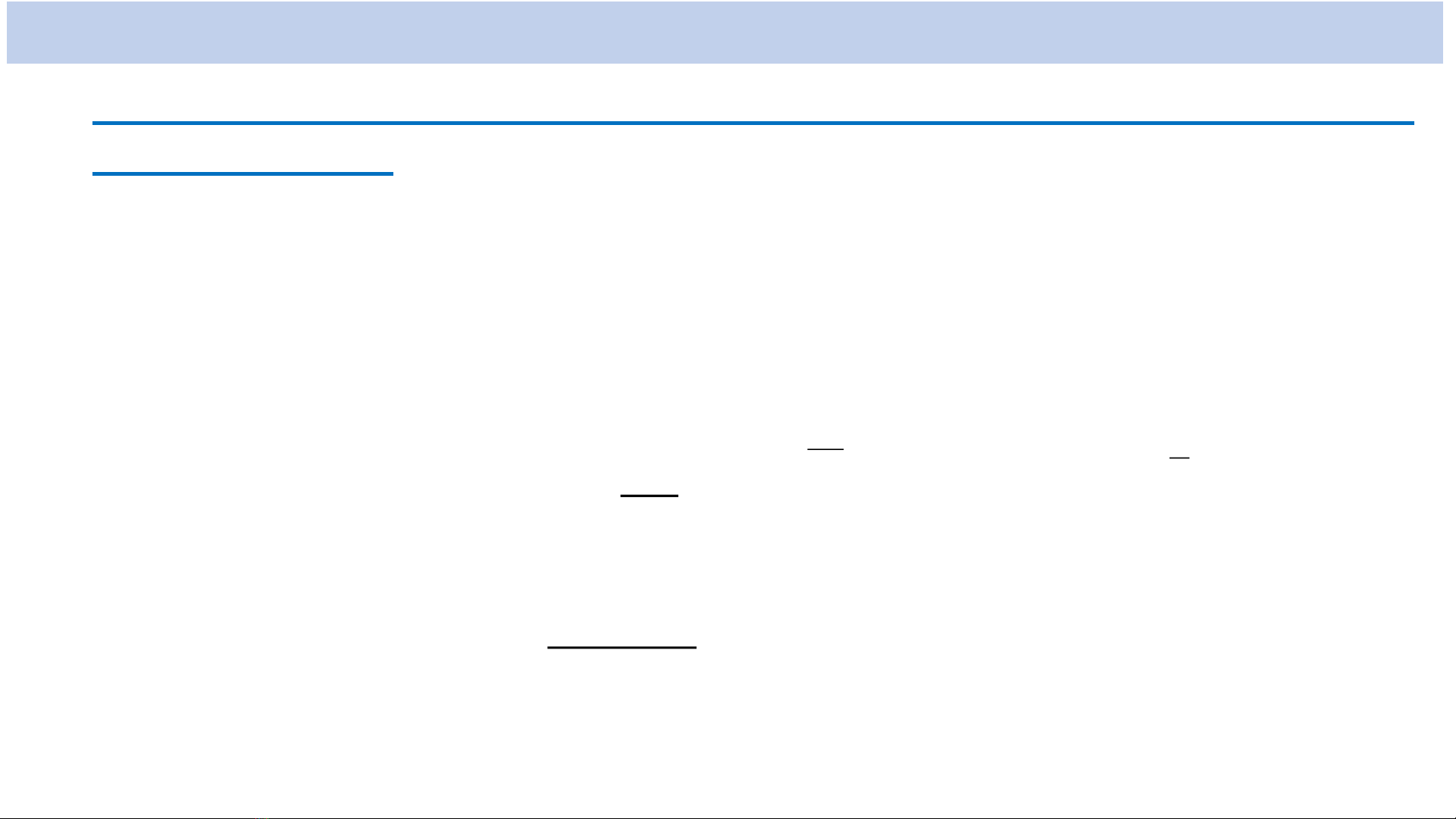
Ví dụ:
),()(),,( 0010100
YrRr
2
1
00
2/3
0
10 )4( ;)
1
(2 0
Ye
a
Ra
r
53,0
4
2
2
0
0 em
a
e
Å
8.1. Nguyên tử Hiđro
1. Phương trình Schrodinger và nghiệm (thừa nhận) cho electron trong
nguyên tử Hiđro
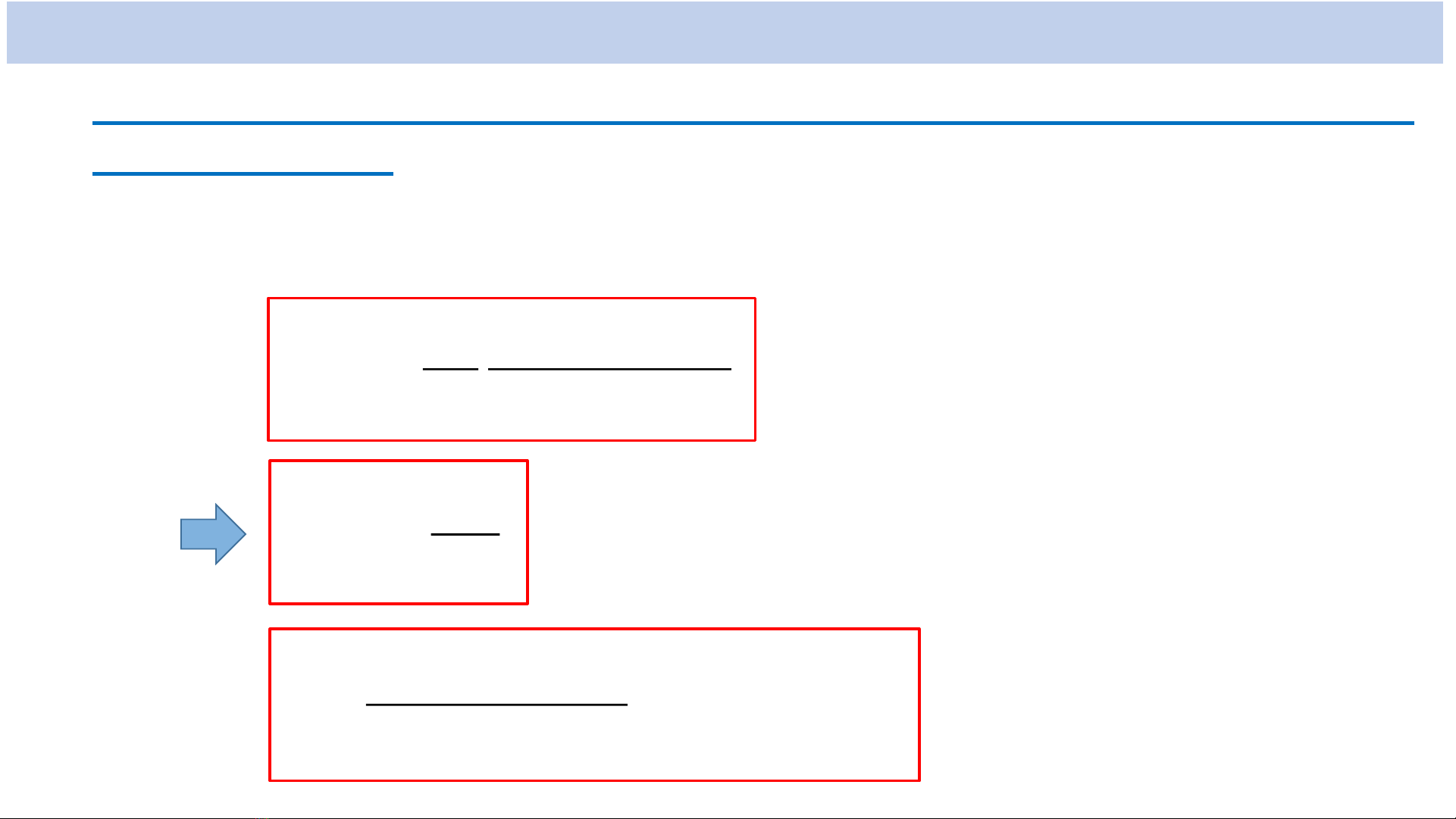
*Năng lượng của electron trong nguyên tử Hiđro:
)4(2
m
1
22
0
4
e
2
e
n
En
Hằng số Rydberg
115
32
0
4
e10.27,3
)4(4
m
R
s
e
2
n
Rh
En
Với
(n = 1, 2, 3, ...: số lượng tử chính)
8.1. Nguyên tử Hiđro


![Bài giảng Cấu tạo vật thể ThS. Nguyễn Hoàng Thông [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250707/nguyenhoangthong.hui@gmail.com/135x160/197_bai-giang-cau-tao-vat-the-ths-nguyen-hoang-thong.jpg)























