ĐỀ CHÍNH THỨC
SỞ GDĐT TỈNH QUẢNG NAM
TRƯỜNG THPT ÂU CƠ
(Đề gồm có 2 trang)
KIỂM TRA GIỮA KỲ I NĂM HỌC 2024 - 2025
Môn: HÓA HỌC - Lớp 11
Thời gian: 45 phút (không kể thời gian giao đề)
Mã đề Gốc
A. TRẮC NGHIỆM (7,0 điểm)
Phần I. (4,0 điểm) Câu trắc nghiệm nhiều phương án lựa chọn. Học sinh trả lời từ câu 1
đến câu 16. Mỗi câu hỏi học sinh chỉ chọn 1 phương án.
Câu 1: Phản ứng thuận nghịch là phản ứng
A. có phương trình hoá học được biểu diễn bằng mũi tên một chiều.
B. chỉ xảy ra theo một chiều nhất định.
C. xảy ra giữa hai chất khí.
D. xảy ra theo hai chiều ngược nhau trong cùng điều kiện.
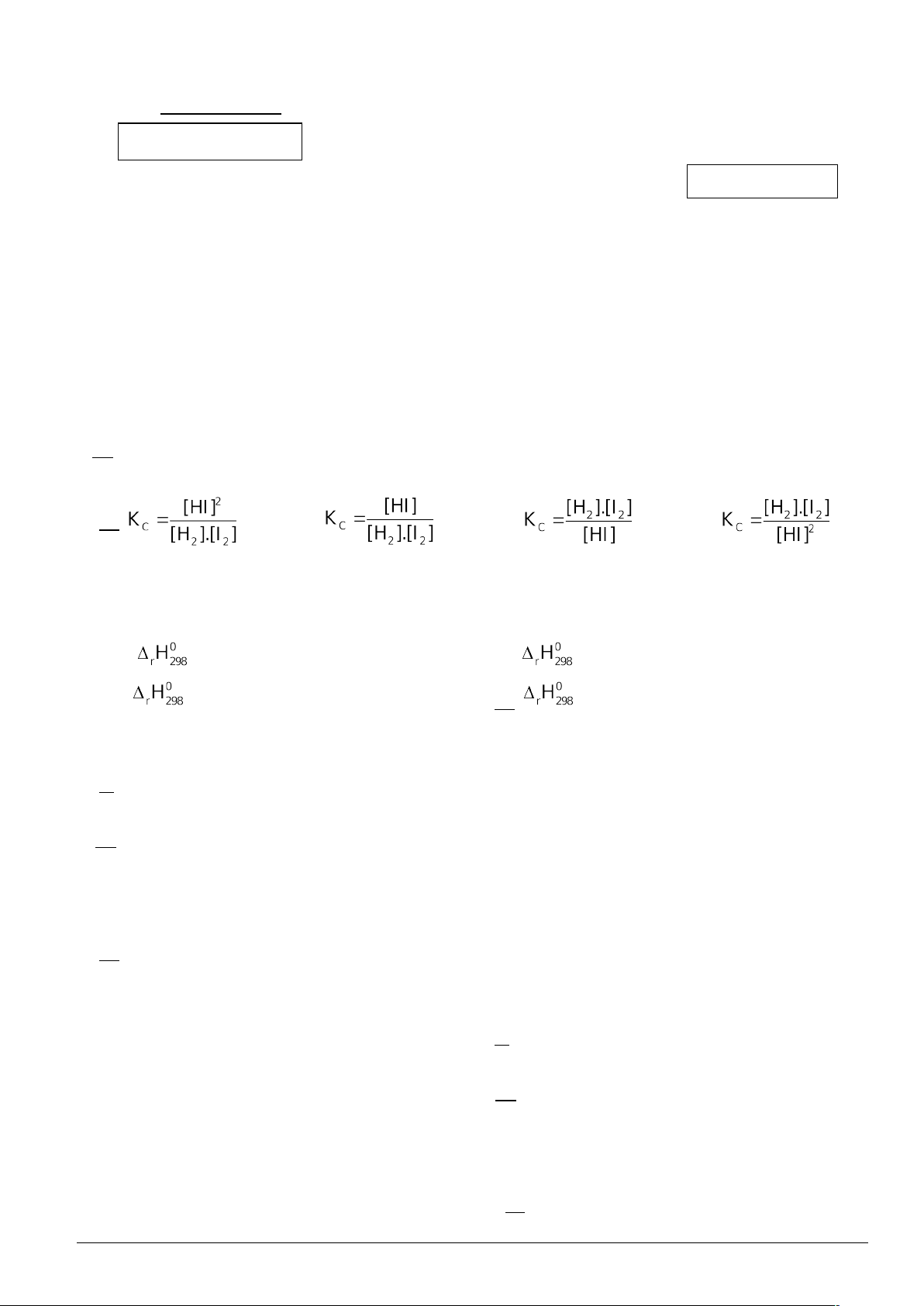
Câu 2: Biểu thức tính hằng số cân bằng của phản ứng: H2(g) + I2(g) ⇌ 2HI(g) là
A. .B. . C. . D. .
Câu 3: Cho cân bằng sau trong bình kín: 2NO2 (g) ⇌ N2O4 (g)
(màu nâu đỏ) (không màu)
Biết khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng thuận có
A. < 0, phản ứng thu nhiệt. B. > 0, phản ứng tỏa nhiệt.
C. > 0, phản ứng thu nhiệt. D. < 0, phản ứng tỏa nhiệt.
Câu 4: Các yếu tố ảnh hưởng đến cân bằng hoá học là
A. nồng độ, nhiệt độ và chất xúc tác. B. nồng độ, áp suất và diện tích bề mặt.
C. nồng độ, nhiệt độ và áp suất. D. áp suất, nhiệt độ và chất xúc tác.
Câu 5: Chất nào sau đây là chất điện li yếu?
A. Acetic acid. B. Potassium nitrate.
C. Saccharose. D. Hydrochloric acid.
Câu 6: Phương trình điện li nào dưới đây viết không đúng?
A. H2SO4 ⟶ 2H+ + SO42- B. CH3COOH ⇌ CH3COO- + H+
C. KOH ⇌ K+ + OH- D. Ba(NO3)2 ⟶ Ba2+ + 2NO3-
Câu 7: Cho phương trình: NH3 + H2O ⇌ NH4+ + OH-. Trong phản ứng nghịch, theo thuyết
Bronsted - Lowry chất nào là acid?
A. NH3.B. H2O. C. NH4+.D. OH-.
Câu 8: Khi nhúng giấy quỳ tím vào dung dịch nào sau đây thì quỳ tím sẽ hoá xanh?
A. HCl. B. K2SO4. C. Na2CO3. D. KCl.
Câu 9: Sau cơn mưa dông kèm sấm sét, nitrogen sẽ được chuyển hóa thành ion nitrate là một
dạng phân đạm mà cây trồng hấp thụ được để sinh trưởng, phát triển. Phản ứng nào sau đây
không có mặt trong quá trình đó?
A. 4NO2 + O2 + 2H2O 4HNO3.B. N2 + 3H2 ⇌ 2NH3.
Trang 1/3 – Mã đề Gốc

C. 2NO + O2 2NO2.D. N2 + O2 ⇌ 2NO.
Câu 10: Ứng dụng nào sau đây không phải của nitrogen?
A. Tổng hợp ammonia. B. Bảo quản thực phẩm.
C. Tác nhân làm lạnh. D. Sản xuất phân lân.
Câu 11: Nitric acid hoà tan được hầu hết kim loại (trừ Au và Pt) là vì nitric acid có tính
A. khử mạnh. B. acid mạnh. C. base mạnh. D. oxi hoá mạnh.
Câu 12: Nhiệt phân muối nào sau đây không thu được NH3?
A. (NH4)2CO3.B. NH4HCO3.C. NH4Cl. D. NH4NO3.
Câu 13: Hiện tượng xảy ra trong thí nghiệm nào sau đây đã mô tả sai?
A. Khi cho khí HCl tiếp xúc với khí NH3 thấy xuất hiện khói trắng.
B. Nhỏ dung dịch BaCl2 vào dung dịch (NH4)2SO4 thấy xuất hiện kết tủa trắng.
C. Đun nóng dung dịch đặc của NH4Cl và NaOH thì thoát ra khí có mùi trứng thối.
D. Nhỏ phenolphthalein vào dung dịch NH3, thu được dung dịch có màu hồng.
Câu 14: Các chất khí điều chế trong phòng thí nghiệm thường được thu theo phương pháp
đẩy không khí (cách 1, cách 2) hoặc đẩy nước (cách 3) như các hình vẽ dưới đây:
Có thể sử dụng cách thu khí nào để thu được khí ammonia?
A. Cách 3. B. Cách 1.
C. Cách 2. D. Cách 2 và cách 3.
Câu 15: Mưa acid là hiện tượng nước mưa có pH nhỏ hơn 5,6. Hai tác nhân chính gây mưa
acid là
A. CO và CH4.B. CH4 và NH3.C. SO2 và NOx.D. CH4 và CO2.
Câu 16: Ở điều kiện thích hợp, sulfur đóng vai trò là chất khử khi phản ứng với chất nào sau
đây?
A. O2.B. Fe. C. Hg. D. H2.
Phần II. (2,0 điểm) Câu trắc nghiệm đúng sai. Học sinh trả lời từ câu 1 đến câu 2. Trong
mỗi ý a), b), c), d) ở mỗi câu, học sinh chọn đúng hoặc sai.
Câu 1: Sản xuất amoniac trong công nghiệp dựa trên phản ứng sau:
N2(g) + 3H2(g) ⇌ 2NH3(g) (ΔrH0298<0)
a) Phản ứng theo chiều thuận tỏa nhiệt.
b) Tăng áp suất chung của hệ, cân bằng hóa học chuyển dịch theo chiều nghịch.
c) Giảm nồng độ NH3, cân bằng hóa học chuyển dịch theo chiều thuận.
d) Sản phẩm của phản ứng chỉ thu được NH3.
Câu 2: Khi tiến hành thí nghiệm chuẩn độ acid - base, trong burette đựng dung dịch NaOH,
trong bình tam giác đựng dung dịch HCl (đã biết nồng độ) và thuốc thử phenolphtalein.
a) Khi dung dịch trong bình tam giác từ không màu chuyển sang màu hồng bền trong 30
giây thì dừng chuẩn độ.
b) Phải thực hiện chuẩn độ tối thiểu 3 lần.
c) Tại điểm tương đương, thể tích NaOH bằng thể tích dung dịch HCl.
Trang 2/3 – Mã đề Gốc

d) Khi chuẩn độ cần để chất lỏng chảy từ từ theo thành bình tam giác.
Phần III. (1,0 điểm) Câu trắc nghiệm trả lời ngắn. Học sinh trả lời từ câu 1 đến câu 2.
Câu 1: Để chuẩn độ 400 mL dung dịch HCl chưa rõ nồng độ, người ta đã dùng trung bình hết
100 mL dung dịch NaOH 0,12M. Tính nồng độ mol của dung dịch HCl.
Câu 2: Một loại sữa rửa mặt có [H+] = 3,16. 10-6M. Giá trị pH của sữa rửa mặt bằng bao
nhiêu?
B. TỰ LUẬN (3,0 điểm)
Câu 1. (1,0 điểm)
a. Viết phương trình điện li các chất: Ca(NO3)2; CH3COOH.
b. Hoàn thành các phương trình phản ứng hóa học sau (nếu có):
NH3 + O2
o
t
NH3 + H2SO4 →
Câu 2. (1,0 điểm) Trình bày cách nhận biết hai muối được dùng làm phân bón hóa học sau:
NH4NO3, KNO3.
Câu 3. (1,0 điểm) Một mẫu nước thải của nhà máy sản xuất có pH = 4. Để thải ra noài môi
trường thi cần phải tăng pH lên từ 5,8 đến 8,6 (theo đúng quy định). Nhà máy phải dùng vôi
sống thả vào nước thải, khối lượng vôi sống cần dùng cho 1m3‰nước để tăng pH‰ từ 4 lên 7 là
bao nhiêu? (Bỏ qua sự thủy phân của các muối nếu có).
------------- HẾT -------------
Học sinh không được sử dụng tài liệu. Cán bộ coi kiểm tra không giải thích gì thêm.
Họ và tên học sinh,:...................................................................SBD:..........................
Đông Giang, ngày 21 tháng 10 năm 2024
DUYỆT
CỦA BAN GIÁM HIỆU
ALĂNG HẬU
GIÁO VIÊN
TRẦN THỊ NHƯ QUỲNH
Trang 3/3 – Mã đề Gốc


![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)




![Đề thi học kì 2 Vật lý lớp 11: Đề minh họa [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250709/linhnhil/135x160/711752026408.jpg)








