
ĐỀ CHÍNH THỨC
SỞ GDĐT TỈNH QUẢNG NAM
TRƯỜNG THPT ÂU CƠ
(Đề gồm có 2 trang)
KIỂM TRA GIỮA KỲ I NĂM HỌC 2024 - 2025
Môn: HÓA HỌC - Lớp 10
Thời gian: 45 phút (không kể thời gian giao đề)
Mã đề Gốc
A. TRẮC NGHIỆM (7,0 điểm)
Phần I. (4,0 điểm) Câu trắc nghiệm nhiều phương án lựa chọn. Học sinh trả lời từ câu 1 đến
câu 16. Mỗi câu hỏi học sinh chỉ chọn 1 phương án.
Câu 1: Trong các bước của phương pháp nghiên cứu hóa học, không có bước nào sau đây?
A. Nêu giả thuyết khoa học. B. Xác định vấn đề nghiên cứu.
C. Thực hiện nghiên cứu. D. Xây dựng bản thiết kế kĩ thuật.
Câu 2: Hiện tượng nào sau đây là hiện tượng hoá học?
A. Băng tan ở 2 cực. B. Cơm bị ôi thiu.
C. Sắt bị nam châm hút. D. Nước hoá đá ở 00C.
Câu 3: Cho các phát biểu sau:
(1) Tất cả các hạt nhân nguyên tử đều được cấu tạo từ các hạt proton và neutron.
(2) Khối lượng nguyên tử tập trung phần lớn ở lớp vỏ.
(3) Trong nguyên tử, số electron bằng số proton.
(4) Trong hạt nhân nguyên tử, hạt mang điện là proton và electron.
(5) Trong nguyên tử, hạt electron có khối lượng không đáng kể so với các hạt còn lại.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 4: Khối lượng nguyên tử tập trung hầu hết ở đâu?
A. Hạt nhân nguyên tử. B. Vỏ nguyên tử. C. Electron. D. Neutron.
Câu 5: Trong nguyên tử, hạt mang điện là
A. proton và neutron. B. proton và electron.
C. electron. D. electron và neutron.
Câu 6: Định nghĩa về đồng vị nào sau đây đúng?
A. Đồng vị của một nguyên tố hóa học là những nguyên tử có cùng số khối.
B. Đồng vị của một nguyên tố hóa học là những nguyên tử có cùng số electron.
C. Đồng vị của một nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân và
cùng số khối.
D. Đồng vị của một nguyên tố hóa học là những nguyên tử có cùng số proton, khác nhau số
neutron.
Câu 7: Một nguyên tử (X) có 13 proton trong hạt nhân. Khối lượng của proton trong hạt nhân
nguyên tử X là
A. 21,76.10-23hgam. hhhh B. 21,75.10-24hgam. C. 27 amu. hhhh D. 13 gam.
Câu 8: Hạt nhân của nguyên tử nào có số hạt neutron là 12?
A. B. C. D.
Trang 1/3 – Mã đề Gốc
Câu 9: Sự phân bố electron vào các orbital (AO) nào dưới đây là đúng?
A. .B. .C. .D. .
Câu 10: Nguyên tử nguyên tố X có cấu hình electron lớp ngoài cùng là 3s23p5. X là nguyên tố
A. khí hiếm. B. kim loại. C. kim loại hoặc phi kim. D. phi kim.
Câu 11: Phân lớp 3d có số electron tối đa là
A. 6. B. 18. C. 10. D. 14.
Câu 12: Ô nguyên tố trong bảng tuần hoàn không cho biết thông tin nào sau đây?
A. Kí hiệu nguyên tố. B. Tên nguyên tố.
C. Số hiệu nguyên tử. D. Số khối của hạt nhân.
Câu 13: Đối với các nguyên tố nhóm A trong bảng tuần hoàn các nguyên tố hóa học, trong
một chu kì, theo chiều tăng của điện tích hạt nhân, độ âm điện của nguyên tố
A . có xu hướng tăng dần. B. có xu hướng giảm dần.
C. có xu hướng không đổi. D. không dự đoán được xu hướng biến đổi.
Câu 14: Nguyên tố Cl (Z=17) có số electron hoá trị là
A. 4. B. 5. C. 6. D. 7.
Câu 15: Số nguyên tố trong chu kì 3 và chu kì 5 lần lượt là
A. 18 và 8. B. 18 và 18. C. 8 và 18. D. 8 và 8.
Câu 16: Cho cấu hình electron của phosphorus (P) là [Ne]3s23p3. Xác định vị trí của nguyên
tố P trong bảng tuần hoàn.
A. Ô thứ 15, chu kỳ 3, nhóm VA. B. Ô thứ 5, chu kỳ 3, nhóm VA.
C. Ô thứ 15, chu kỳ 5, nhóm IIIA. D. Ô thứ 5, chu kỳ 5, nhóm IIIA.
Phần II. (2,0 điểm) Câu trắc nghiệm đúng sai. Học sinh trả lời từ câu 1 đến câu 2. Trong
mỗi ý a), b), c), d) ở mỗi câu, học sinh chọn đúng hoặc sai.
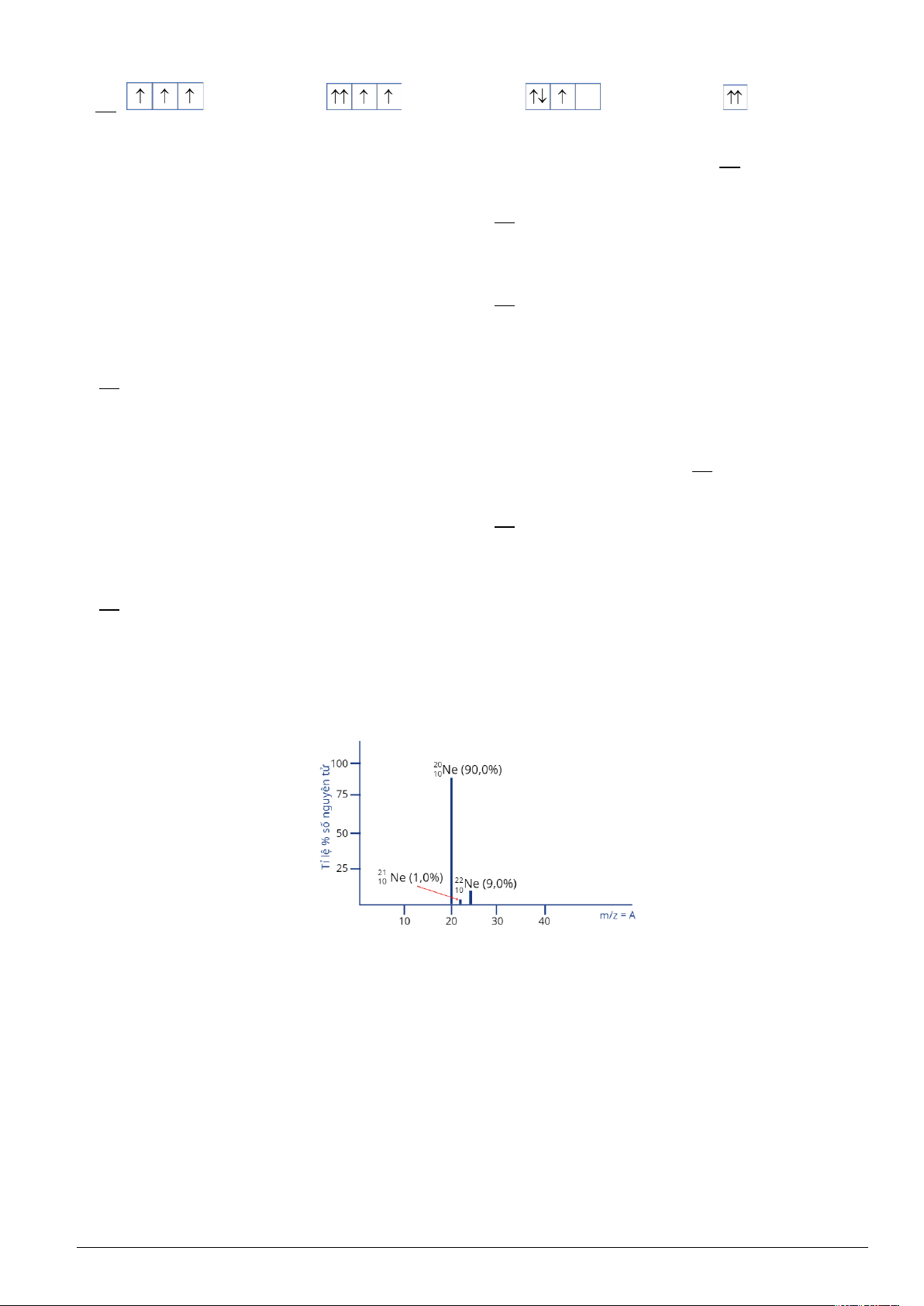
Câu 1: Cho phổ khối của nguyên tố Ne được biểu diễn như sau:
a) Nguyên tử khối trung bình của nguyên tố Ne là 20,19.
b) Có tổng cộng 4 đồng vị của Ne trên phổ khối.
c) Phần trăm số nguyên tử của đồng vị có số khối 20 là cao nhất.
d) Nguyên tố Ne không có đồng vị với số khối là 21.
Câu 2: Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử
của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng.
Nguyên tử X và Y có số electron hơn kém nhau là 2. Biết nguyên tố Y không phải nguyên tố
họ d.
a) Cấu hình electron của X và Y lần lượt là: 1s22s22p63s23p5; 1s22s22p63s23p64s1.
b) X là nguyên tố kim loại, Y là nguyên tố phi kim.
Trang 2/3 – Mã đề Gốc

c) Nitrogen (Z = 7) có cùng số electron lớp ngoài cùng với X.
d) Ở trạng thái cơ bản X có 3 electron độc thân, Y có 1 electron độc thân.
Phần III. (1,0 điểm) Câu trắc nghiệm trả lời ngắn. Học sinh trả lời từ câu 1 đến câu 2.
Câu 1: Nguyên tố A thuộc chu kì 2, nhóm VIA trong bảng tuần hoàn các nguyên tố hóa học.
Nguyên tử của nguyên tố A có số electron là bao nhiêu?
Câu 2: Mg có 3 đồng vị 24Mg, 25Mg và 26Mg. Clo có 2 đồng vị 35Cl và 37Cl. Có bao nhiêu loại
phân tử MgCl2 khác nhau tạo nên từ các đồng vị của 2 nguyên tố đó ?
B. TỰ LUẬN (3,0 điểm)
Câu 1: (1,0 điểm) Nitrogen lỏng được dùng để bảo quản máu, tế bào, dịch cơ thể, trứng, ...
Biết nguyên tử nitrogen có tổng số hạt là 21. Số hạt không mang điện chiếm 33,33%. Xác
định số khối của X và viết kí hiệu của nguyên tử X.
Câu 2: (1,0 điểm) Nguyên tố Sulfur (S) có Z=16.
a. Viết cấu hình electron của S.
b. Dự đoán được tính chất hoá học cơ bản của S (kim loại, phi kim hay khí hiếm), giải
thích?
c. Biểu diễn cấu hình electron lớp ngoài cùng dạng AO, xác định số electron độc thân của S
ở trạng thái cơ bản.
Câu 3: (1,0 điểm) Nguyên tố Copper có 2 đồng vị, trong đó chiếm 73 % còn lại là
. Tính phần trăm về khối lượng của trong Cu2O.(Với oxygen là đồng vị )?
------------- HẾT -------------
Học sinh không được sử dụng tài liệu. Cán bộ coi kiểm tra không giải thích gì thêm.
Họ và tên học sinh,:...................................................................SBD:..........................
Đông Giang, ngày 21 tháng 10 năm 2024
DUYỆT
CỦA BAN GIÁM HIỆU
ALĂNG HẬU
GIÁO VIÊN
TRẦN THỊ NHƯ QUỲNH
Trang 3/3 – Mã đề Gốc


![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)




![Đề thi học kì 2 Vật lý lớp 11: Đề minh họa [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250709/linhnhil/135x160/711752026408.jpg)








