
TRƯỜNG THPT HOÀI ĐỨC B
TỔ BỘ MÔN HÓA HỌC
(Đề có 4 trang)
ĐỀ MẪU KIỂM TRA GIỮA KỲ 2
Môn : HÓA HỌC 10
Thời gian làm bài: 45 phút không kể thời gian phát đề
Họ và tên học sinh……………………………………….
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi
thí sinh chỉ chọn một phương án. (3 điểm)
Câu 1. Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là dựa trên sự thay đổi đại lượng nào sau đây của
nguyên tử?
A. Số khối. B. Số oxi hóa. C. Số hiệu D. Số mol.
Câu 2. Cho quá trình Al → Al3+ + 3e, đây là quá trình
A. khử. B. oxi hóa. C. tự oxi hóa – khử. D. nhận proton.
Câu 3. Calcium chloride dùng trong điện phân để sản xuất calcium kim loại và điều chế các hợp kim của
calcium. Trong phản ứng tạo thành calcium (II) chloride từ đơn chất: Ca + Cl2
⎯⎯→
CaCl2
Kết luận nào sau đây đúng ?
A. Mỗi nguyên tử calcium nhận 2e B. Mỗi nguyên tử chlorine nhận 3e
C. Mỗi phân tử chlorine nhường 2e. D. Mỗi nguyên tử calcium nhường 2e
Câu 4. Phát biểu nào sau đây không đúng ?
A. Số oxi hóa của nguyên tử trong hợp chất là điện tích của nguyên tử đó với giả thiết đó là hợp chất ion.
B. Trong hợp chất, oxygen có số oxi hóa bằng -2, trừ một số trường hợp ngoại lệ.
C. Số oxi hóa của hydrogen trong các hydride kim loại bằng +1.
D. Các nguyên tố phi kim có số oxi hóa thay đổi tùy thuộc vào hợp chất chứa chúng.
Câu 5. Dẫn khí H2 đi qua ống sứ đựng bột CuO nung nóng để thực hiện phản ứng hóa học sau:
CuO + H2
o
t
⎯⎯→
Cu + H2O. Trong phản ứng trên, chất đóng vai trò chất khử là
A. CuO. B. H2. C. Cu. D. H2O.
Câu 6. Phản ứng tỏa nhiệt là phản ứng trong đó
A. hỗn hợp phản ứng truyền nhiệt cho môi trường. B. chất phản ứng truyền nhiệt cho sản phẩm.
C. chất phản ứng thu nhiệt từ môi trường D. các chất sản phẩm thu nhiệt từ môi trường.
Câu 7. Nhiệt tạo thành chuẩn của một chất là nhiệt lượng tạo thành 1 mol chất đó từ chất nào ở điều kiện
chuẩn?
A. những hợp chất bền vững nhất. B. những đơn chất bền vững nhất.
C. những oxide có hóa trị cao nhất. D. những dạng tồn tại bền nhất trong tự nhiên.
Câu 8. Kí hiệu biến thiên enthalpy (nhiệt phản ứng) của phản ứng ở điều kiện chuẩn là
A.
o
r 298
H
B.
o
f 298
H
C.
rH
D.
fH
Câu 9. Quy ước về dấu của nhiệt phản ứng (
o
r 298
H
) nào sau đây là đúng?
A. Phản ứng tỏa nhiệt có
o
r 298
H
> 0. B. Phản ứng thu nhiệt có
o
r 298
H
< 0.
C. Phản ứng tỏa nhiệt có
o
r 298
H
< 0. D. Phản ứng thu nhiệt có
o
r 298
H
= 0.
Câu 10. Những phát biểu nào sau đây đúng ?
A. Biến thiên enthalpy chuẩn của một phản ứng hóa học là lượng nhiệt kèm theo phản ứng đó ở áp suất
1 atm và 250C.
B. Nhiệt (tỏa ra hay thu vào) kèm theo một phản ứng hóa học được thực hiện ở 1bar và 298k là biến thiên
enthalpy chuẩn của phản ứng đó.
C. Một số phản ứng khi xảy ra làm môi trường xung quanh nóng lên là phản ứng thu nhiệt.

D. Một số phản ứng khi xảy ra làm môi trường xung quanh lạnh đi là do các phản ứng này tỏa nhiệt và
lấy nhiệt từ môi trường.
Câu 11. Đèn xì ogygen – acetylene khi hoạt động, phản ứng đốt cháy giữa hai ống dẫn khí trong đèn xảy
theo phương trình: C2H2 + O2
0
t
⎯⎯→
CO2 + H2O (*)
Đèn xì ogygen – acetylene
Phản ứng tỏa nhiệt lớn, tạo ra ngọn lửa có nhiệt độ đạt đến 3000oC nên được dùng để hàn cắt kim loại.
Phát biểu nào dưới đây là đúng?
A. Trong phản ứng (*) chất bị khử là O2.
B. Trong phản ứng (*) chất nhường electron là O2.
C. Trong phản ứng (*) chất oxi hóa là C2H2.
D. Trong phản ứng (*), mỗi phân tử O2 đã nhường đi 4 electron.
Câu 12. Nung KNO3 lên 5500C xảy ra phản ứng: KNO3(s)
⎯⎯→
KNO2(s) +
o
2 r 298
1O (g) H ?
2
Phản ứng nhiệt phân KNO3 là phản ứng
A. toả nhiệt, có
o
r 298
H
< 0. B. thu nhiệt, có
o
r 298
H
< 0.
C. toả nhiệt, có
o
r 298
H
> 0. D. thu nhiệt, có
o
r 298
H
> 0.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 2. Trong mỗi ý a), b), c), d) ở mỗi
câu, thí sinh chọn đúng hoặc sai. (2 điểm)
Câu 1. Diêm là một dụng cụ tạo lửa phổ biến từ thời kỳ cận đại tới nay.Diêm an toàn được thiết kế bằng
việc sử dụng phosphor đỏ vốn không tự cháy khi ma sát thông thường, nhưng nếu trộn với potassium chlorate
(KClO3) thì lại dễ cháy. Trong sản phẩm diêm an toàn hiện nay, KClO3 được tách riêng khỏi phosphor đỏ
để ngăn cháy ngoài ý muốn. Que diêm được thiết kế dưới dạng que nhỏ làm bằng gỗ, đầu tẩm lưu huỳnh và
bọc KClO3. Vỏ bao diêm (hoặc tờ bìa đi kèm kẹp diêm) thì bôi phosphor đỏ. Người sử dụng quẹt đầu KClO3
vào phần phosphor đỏ để ma sát tạo ra sự cháy. Các phản ứng xảy ra khi đốt cháy diêm:
2KClO3
o
t
⎯⎯→
2KCl +3O2 (1)
S6Sb4 + 9O2
o
t
⎯⎯→
6SO2 + 2Sb2O3 (2)
4P + 5O2
o
t
⎯⎯→
2P2O5 (3)
a. Phản ứng (1) là phản ứng tự oxi hóa - khử.
b. Phản ứng (2) O2 là chất oxi hóa.
c. Phosphor đỏ có khả năng tự cháy khi ma sát.
d. Phản ứng (3) Chất khử là P, chất oxi hóa là O2.
Câu 2. Cho phương trình nhiệt hóa sau:
C2H5OH(l) + 3O2(g)
o
t
⎯⎯→
2CO2(g) + 3H2O(g)
298 1234,83
o
rH kJ = −
a. Phản ứng trên là phản ứng tỏa nhiệt.
b. Nhiệt tạo thành của O2(g) bằng 0.
c. Tổng enthalpy tạo thành của các chất tham gia phản ứng trên nhỏ hơn tổng enthalpy của sản phẩm.
d. Để đốt cháy 1 mol chất lỏng C2H5OH cần nhiệt lượng là 1234,83 kJ.

PHẦN III: Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 8. (2 điểm)
Câu 1. Có bao nhiêu hợp chất có nguyên tử nguyên tố nitrogen có số oxi hóa dương trong dãy các chất sau:
NH3, NO, NO2, N2, HNO3?
Câu 2. Cho các phản ứng sau và biến thiên enthalpy chuẩn:
(1) 2NaHCO3(s)
⎯⎯→
Na2CO3(s) + H2O(l) + CO2 (g)
0
r 298
H
= +20,33 kJ
(2) 4NH3 (g) +3O2(g)
⎯⎯→
2N2(g) + H2O(l)
0
r 298
H
= -1531 kJ
(3) CaCO3(s)
⎯⎯→
CaO(s) + CO2(g)
0
r 298
H
= +176,0 kJ
(4) C2H4(g) + H2(g)
⎯⎯→
C2H6(g)
0
r 298
H
= -137,0 kJ
(5) Fe2O3(s) + 2Al(s)
⎯⎯→
Al2O3(s) + 2Fe(s)
0
r 298
H
= -851,5 kJ
Có bao nhiêu phản ứng thu nhiệt?
Câu 3. Cho sơ đồ chuyển hóa nitrogen như sau:
o
2 2 2 2
O O O H O CuO t
2 2 3 3 2 2
(1) (2) (3) (4) (5)
N NO NO HNO Cu(NO ) NO
+ + + + +
⎯⎯⎯→ ⎯⎯⎯→ ⎯⎯⎯⎯→ ⎯⎯⎯→ ⎯⎯→
Có bao nhiêu phản ứng oxi hóa khử ở sơ đồ trên?
Câu 4. Chloromethane (CH3Cl), còn được gọi là methyl chloride, Refrigerant-40 hoặc HCC 40. CH3Cl từng
được sử dụng rộng rãi như một chất làm lạnh. Hợp chất khí này rất dễ cháy, có thề không mùi hoặc có mùi
thơm nhẹ. Biến thiên enthalpy của phản ứng: CH4(g) + Cl2(g)
⎯⎯→
CH3Cl(g) + HCl(g) bằng bao nhiêu kJ?
(kết quả làm tròn tới hàng đơn vị)
Biết năng lượng liên kết của một số liên kết như sau:
Liên kết
C – H
Cl – Cl
H – Cl
C – Cl
Eb (kJ/mol)
414
243
431
339
Câu 5. Cho phản ứng:
3 3 3 2
aFe bHNO cFe(NO ) dNO eH O.+ ⎯⎯→ + +
Các hệ số a, b, c, d, e là những số nguyên, tối giản. Tổng (a + b) bằng bao nhiêu?
Câu 6. Câu 6. Cho phản ứng sau : 4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2.
0
298
rH
= a
Giá trị biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn bằng –a kJ. Biết nhiệt tạo thành
0
f 298
H
của
FeS2(s), Fe2O3(s) và SO2(g) lần lượt là –177,9 kJ/mol, –825,5 kJ/mol và –296,8 kJ/mol. Giá trị của a bằng
bao nhiêu? (kết quả làm tròn đến hàng đơn vị)
Câu 7. Hàm lượng iron (II) sulfate được xác định qua phản ứng oxi hóa – khử với potassium permanganate:
FeSO4 + KMnO4 + H2SO4
⎯⎯→
Fe2(SO4)3 + K2SO4 +MnSO4 +H2O. Tính thể tích KMnO4 0,02M để phản
ứng vừa đủ 20 mL dd FeSO4 0,1M.
Câu 8. Một hộ gia đình mua than đá làm nhiên liệu đun nấu và trung bình mỗi ngày dùng hết 1,60 kg than.
Giả thiết loại than đá trên chứa 90% carbon về khối lượng, còn lại là các tạp chất trơ.
Cho phản ứng: C(s) + O2(g)
⎯⎯→
CO2(g)
o
r 298
H 393,50kJ = −
Nhiệt lượng cung cấp cho hộ gia đình từ quá trình đốt than trong một ngày tương đương bao nhiêu số điện?
Biết rằng 1 số điện = 1 kWh = 3600 kJ. Nguyên tử khối của carbon là 12. (kết quả làm tròn đến hàng đơn
vị)
PHẦN IV: TỰ LUẬN (3 điểm)
Câu 1. (1 điểm) Viết các quá trình nhường hay nhận electron của các biến đổi trong các dãy sau:
2 0 4 6 4 2
S S S S S S
− +++−
⎯⎯→ ⎯⎯→ ⎯⎯→ ⎯⎯→ ⎯⎯→
Câu 2. (1 điểm) Có nhiều vụ tai nạn giao thông xảy ra do người lái xe uống rượu. Theo luật định, hàm lượng
ethanol trong máu người lái xe không vượt quá 0,02% theo khối lượng. Để xác định hàm lượng ethanol trong
máu của người lái xe cần chuẩn độ Cr3+, ethanol (C2H5OH) bị oxi hóa thành acetaldehyde (CH3CHO).

Đo nồng độ ethanol
Tai nạn giao thông do sử dụng ethanol vượt quá
quy định.
Khi chuẩn độ 25 g huyết tương máu của một lái xe cần dùng 20mL dung dịch K2Cr2O7 0,01M. Người lái xe
đó có vi phạm luật hay không ? Tại sao? Giả sử rằng trong thí nghiệm trên chỉ có ethanol tác dụng với
K2Cr2O7.
Câu 3. (1 điểm) Khí gas chứa chủ yếu các thành phần chính: Propane (C3H8), butane (C4H10) và một số
thành phần khác. Để tạo mùi cho gas nhà sản xuất đã pha trộn thêm chất tạo mùi đặc trưng như methanethiol
(CH3SH), có mùi giống tỏi, hành tây. Thành phần khí gas, tỉ lệ hòa trộn phổ biến của propane : butane theo
thứ tự 30 :70 đến 50 : 50.
Cho phương trình nhiệt hóa học sau
C3H8(g) + 5O2(g)
0
t
⎯⎯→
3CO2(g) + 4H2O(g)
0
r 298
H
= -2220 kJ
C4H10(g) +
13
2
O2(g)
0
t
⎯⎯→
4CO2(g) + 5H2O(g)
0
r 298
H
= -2874 kJ
Giả sử một hộ gia đình cần 6 000kJ nhiệt mỗi ngày, sau bao nhiêu ngày sẽ sử dụng hết 1 bình gas (với hiệu
suất hấp thụ nhiệt khoảng 60%).
-------------------------HẾT---------------------
ĐÁP ÁN
PHẦN I. (Mỗi câu trả lời đúng thí sinh được 0,25 điểm).
1 – B
2 –B
3 –D
4 -C
5 –B
6 –A
7 –B
8 -A
9 -C
10 –B
11 –A
12 –D
PHẦN II. Điểm tối đa của 01 câu hỏi là 1 điểm.
- Thí sinh chỉ lựa chọn chọn chính xác 01 ý trong 1 câu hỏi được 0,1 điểm.
- Thí sinh chỉ lựa chọn chọn chính xác 02 ý trong 1 câu hỏi được 0,25 điểm.
- Thí sinh chỉ lựa chọn chọn chính xác 03 ý trong 1 câu hỏi được 0,5 điểm.
- Thí sinh chỉ lựa chọn chọn chính xác 04 ý trong 1 câu hỏi được 1,0 điểm.
Câu
Ý
Đáp án
Câu
Ý
Đáp án
1
a
S
2
A
Đ
b
Đ
B
Đ
c
S
C
S
d
Đ
D
S
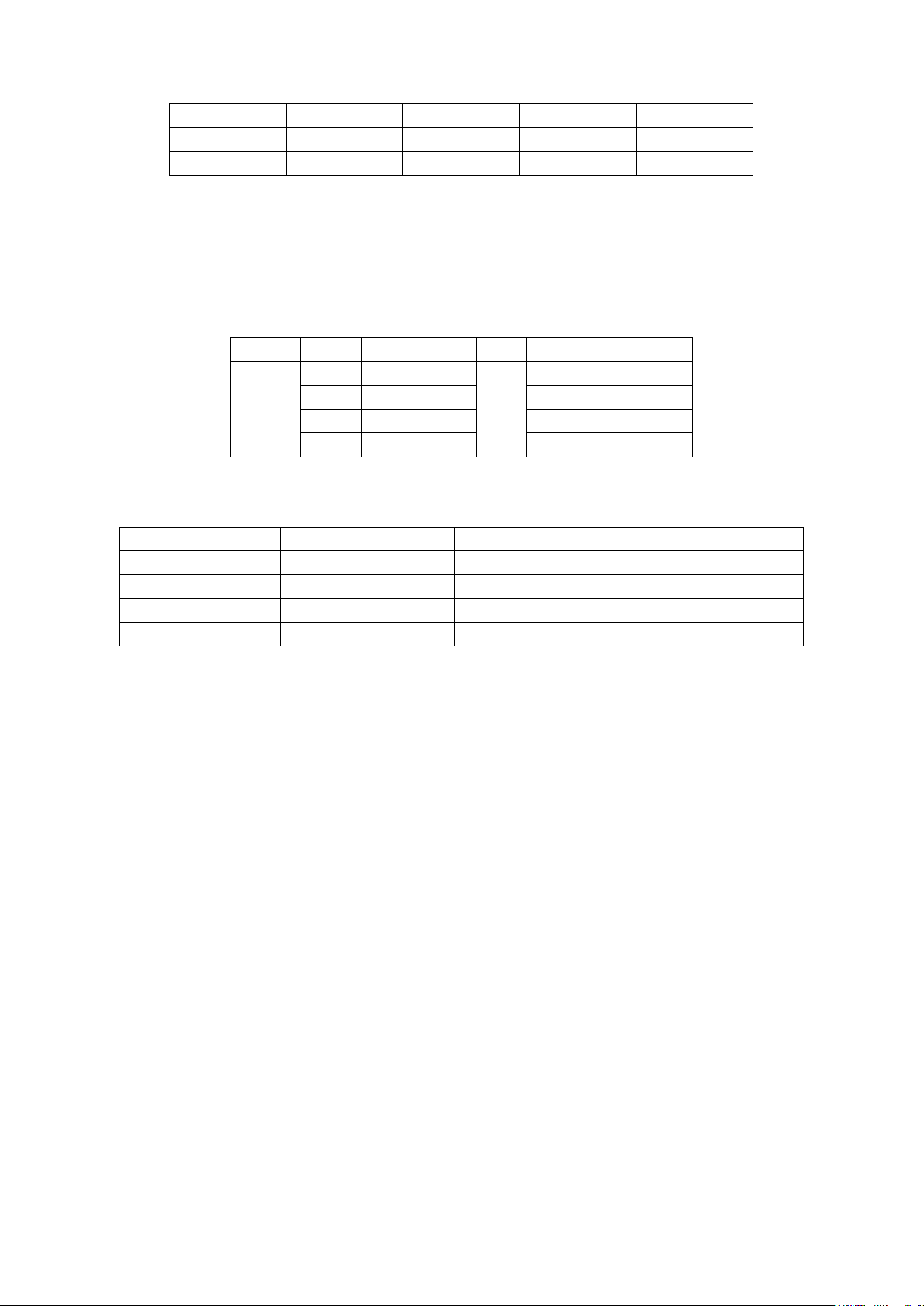
PHẦN III. (Mỗi câu trả lời đúng thí sinh được 0,25 điểm).
- Đáp án
Câu
Đáp án
Câu
Đáp án
1
3
5
5
2
2
6
3314
3
4
7
20
4
-113
8
13
PHẦN IV.
Câu 1. (1 điểm) Mỗi quá trình đúng được 0,2 điểm
20
04
46
64
42
S S 2e
S S 4e
S S 2e
S 2e S
S 6e S
−
+
++
++
+−
⎯⎯→ +
⎯⎯→ +
⎯⎯→ +
+ ⎯⎯→
+ ⎯⎯→
Câu 2. (1 điểm) Có nhiều vụ tai nạn giao thông xảy ra do người lái xe uống rượu. Theo luật định, hàm lượng
ethanol trong máu người lái xe không vượt quá 0,02% theo khối lượng. Để xác định hàm lượng ethanol trong
máu của người lái xe cần chuẩn độ Cr3+, ethanol (C2H5OH) bị oxi hóa thành acetaldehyde (CH3CHO). Khi
chuẩn độ 25 g huyết tương máu của một lái xe cần dùng 20mL dung dịch K2Cr2O7 0,01M. Người lái xe đó
có vi phạm luật hay không ? Tại sao? Giả sử rằng trong thí nghiệm trên chỉ có ethanol tác dụng với K2Cr2O7.
Hướng dẫn giải
a) phương trình hóa học của phản ứng chuẩn độ xảy ra:
3CH3CH2OH +K2Cr2O7 +4H2SO4
⎯⎯→
3CH3CHO + Cr2(SO4)3 +K2SO4 + 7H2O
b)
2 2 7
K Cr O
n
= 0,02.0,01 = 0,0002 mol


![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)




![Đề thi học kì 2 Vật lý lớp 11: Đề minh họa [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250709/linhnhil/135x160/711752026408.jpg)








